13: アルコール脱水素酵素(Alcohol Dehydrogenase)
さぁアルコール脱水素酵素(alcohol dehydrogenase)に乾杯だ。大晦日の晩に飲み過ぎてそれから回復するまでの間、平らげたシャンパンと絶え間なく闘う酵素のことを考えるかもしれない。アルコール脱水素酵素は、私たちの神経機構の機能を低下させる有毒分子であるアルコールに対抗する主な防衛手段となっている。肝臓や胃に高い濃度のアルコール脱水素酵素があると、1時間1杯のペースで強い酒を飲んでも解毒することができる。アルコールはより有毒な分子であるアセトアルデヒドに変換され、その後速やかに酢酸など他の細胞で簡単に利用できる分子に変換される。つまり、潜在的に危険な分子はアルコール脱水素酵素によって単なる食糧に変換されているのである。
形状と機能
私たちの体内では少なくとも9種類のアルコール脱水素酵素が作られており、それぞれ少しずつ性質が異なっている。これら酵素の大半は主に肝臓で見られる。これにはβ3型(PDBエントリー 1htb)およびそれに似た酵素(PDBエントリー 6adh、ウマの肝臓由来)が含まれる。σ(シグマ)型(PDBエントリー 1agn)は胃の内壁で見られる。いずれのアルコール脱水素酵素も2つのサブユニットで構成されており、しかもかなり意外なことに、異なる型のサブユニットを混ぜてくっつけても活性を保った混合2量体ができる。これら酵素はエタノールだけを作用対象としている訳ではなく、レチノール、ステロイド、脂肪酸に対しても重要な調整を行っている。様々な型のアルコール脱水素酵素があることで、常にその時々にぴったり合った働きを持つ酵素を用意できるようにしているのである。
結果
アルコール脱水素酵素は私たちの周辺環境にある一般的な毒物に対抗する防衛線となっている。ところがこの防衛は若干の危険を伴う。アルコール脱水素酵素は他のアルコールも調整し、しばしば危険な産物を作り出してしまう。例えば、メタノールはエタノールを飲めないものにする「変性」のためによく用いられるが、これはアルコール脱水素酵素によってホルムアルデヒドに変換される。ホルムアルデヒドはタンパク質を攻撃し腐らないようにするという危険をもたらす。少量のメタノールでも網膜にある感受性の高いタンパク質が攻撃されて失明を引き起こし、さらに大量に(恐らくコップ1杯)飲むと危険は広がって死を招いてしまう。
アルコールを造る
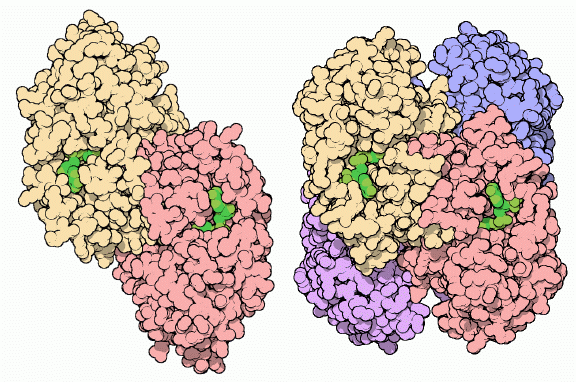
アルコール脱水素酵素は最も古くから行われている生物工学〜アルコール発酵〜でも中心的な役割を果たしている。酵母や多くの細菌はより大きなアルコール脱水素酵素を作る。その一つが、上図右に示したもの(PDBエントリー 1ykf)である。この酵素は食べ物を代謝エネルギーに変換する最終段階を司っており、食べ物を解毒するのではなくエタノールを作っている。糖は分解されエネルギーとして使われるが、この時排泄物としてエタノールができ、細胞を取り囲む液体中に排出される。私たちはこの反応過程をアルコール飲料の生産に利用している。つまり、酵母が穀物の糖を発酵してビールにし、ぶどうジュースを発酵してワインにしているのである。
構造をみる
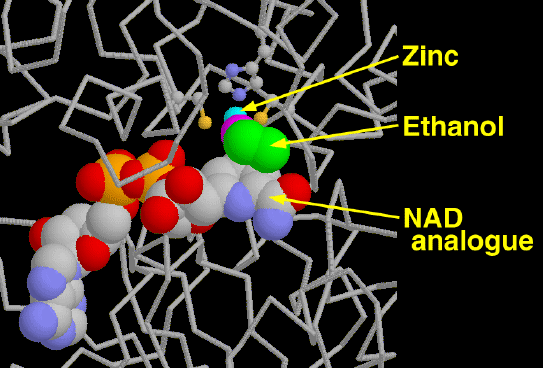
アルコール脱水素酵素はエタノールに対する反応を行う際、2つの分子「道具」を使う。1つは亜鉛イオン(Zn2+)で、エタノールのアルコール基を固定し位置を定める働きをする。もう一つは大きなNAD補因子(ビタミンナイアシンを使ってつくられる)で、これが実際に反応を行う。ここに示した PDBエントリー 1adc の構造では2つの活性部位それぞれにエタノール分子が結合している。この構造分析では少し調整されたNADが用いられている。そのため、酵素はエタノールに直接作用しない。ここで亜鉛イオン(水色の球)がどのようにしてタンパク質中の3つのアミノ酸(左の46番システイン、右の174番システイン、上の67番システイン)に支えられているかに注目して欲しい。エタノール(緑、赤紫色の分子)は亜鉛に結合し、NAD補因子(上図ではエタノールの下に伸びている)のそばに位置している。
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









