88: クラスリン(Clathrin)
タンパク質のひもによる複雑な網細工と魅力的な対称性を持つクラスリン(clathrin)はあなたの注意を引くに違いない。このタンパク質の名前は、電子顕微鏡写真で見ると格子状(clathrate)の外観をしていることにより1960年代に名付けられた。そして今日までこの美しい分子について徹底的な研究が行われている。他の多くのタンパク質と同様に、クラスリンは次の機能の完全形を代表する。クラスリンは細胞内輸送のための球状小胞を形成するのに重要な役割を果たす。
細胞内交通
体内にある細胞のほとんどは、さまざまな種類の細胞小器官(organelle)と呼ばれる膜で囲まれた区画によって区切られている。各区画は、脂質とタンパク質で構築された膜状の表面を持ち、特有の環境を取り囲んでいる。各区画の内部にある分子はそれぞれに特有の仕事を行う。そして、化学効率を向上させ、また多くの場合有害となりうる機能から細胞質を守るため細胞質から隔離されていなければならない。例えば、分解酵素はリソソーム(lysosome)内部にある対象分子を破壊し、酸化酵素はペルオキシソーム(peroxisome)内に保護され、細胞死活性化因子(cell-suicide activator)はミトコンドリア(mitochondria)の内膜内に隔離されている。これらの区画は周囲と隔離されていても、お互いのやりとりはしなくてはならない。なぜなら、古くなったタンパク質の入れ替えや、細胞代謝の反応物と生成物の運搬を行う必要があるからである。細胞は、輸送分子を小胞に入れて細胞小器官の表面から細胞質に押し出し、それが輸送先で小器官と融合することで、遠方へ安全に運搬することができる。多くの場合、小胞は自発的に作られるのではなく、クラスリンなどの被覆タンパク質によって形成が促進される。細胞は、養分の摂取、信号受容体の取り込み、細胞外試料を取り込んだ後の免疫反応仲介、組織炎症後に残った細胞破片のを片付けなどのために細胞膜からさまざまな大きさの小胞を取り込む飲食作用を行う。ところが時には、この飲食機構が病原菌や毒素の侵入経路も提供してしまうのだ!
高速交通
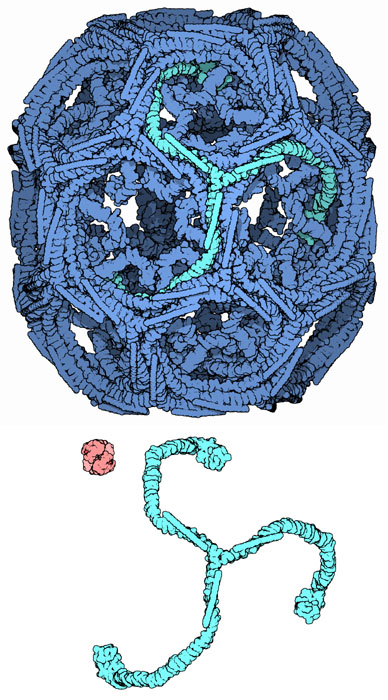
通常のクラスリン被覆小胞は作るのに1分もかからない。この速度は多くの酵素反応に比べると遅いように思えるが、脂質とタンパク質でできた大量の荷物を入れたかばんを輸送する必要があるため、クラスリンによって作られた高分子のかごは一般的な酵素よりもかなり巨大となってしまう結果これだけの時間がかかるのである。クラスリン(右図上)とその左下にある赤色で示したヘモグロビンを比較すればその大きさの違いがよく分かるだろう。例えば、マクロファージ(macrophage)は小胞を使って細胞膜から周辺環境から物質を採取するが、その速度は30〜60分で自身の細胞膜と同面積の小胞を取り込む速さに相当する。一方肝細胞は小胞を使ってトランスフェリンやLDLのような血清タンパク質を大量に分泌する。その分泌量は1日で細胞と同等の量になるぐらいである。小胞が細胞質に入ると、包みは即座に解体されてクラスリンが再利用できるようにする一方、小胞はそれぞれの目的の場所へ輸送されていく。
分子のかご編み職人
クラスリンのかごは「三脚巴構造(トリスケリオン、triskelion)」と呼ばれる対称的な3つの脚を持った構造体で構成されている。ここに示したのはPDBエントリー 1xi4の構造で、36個の三脚でできている。そのうちの1つを緑色で示し目立つようにしてある。溶液中で三脚が集まると、柔軟性のある相互作用を行って、平らな表面を生み出す六角形構造やそれを更に曲げた五角形構造を形成するようになる。細胞の中で、三脚は細胞質を漂って、アダプタータンパク質(後述)と結合し、同時に3つの脚のうちの1つを細胞膜に結合させる。この三脚は膜に結合した他の三脚と結合してサッカーボールのような六角形と五角形で構成される球状格子を形成する。これが膜を押して突き出る。五角形と六角形の組み合わせを変えることで、異なる大きさの小胞を作ることができる。ここに示すのは、かご構造としてとることができる2番目に小さな構造で、実際に機能する小胞を入れるには小さすぎる。これは脂質小胞を取り除き三脚を再構築して実験的に作ったものである。よく写真で見られる最小のクラスリンかごはミニ被膜(mini-coat)と呼ばれ、12個の五角形とたった4個の六角形とでできている。六角形が1つもないもっと小さなかごは、恐らく天然のタンパク質から作られることはないだろう。それは三脚の脚が大きすぎるからである。
特別な配達
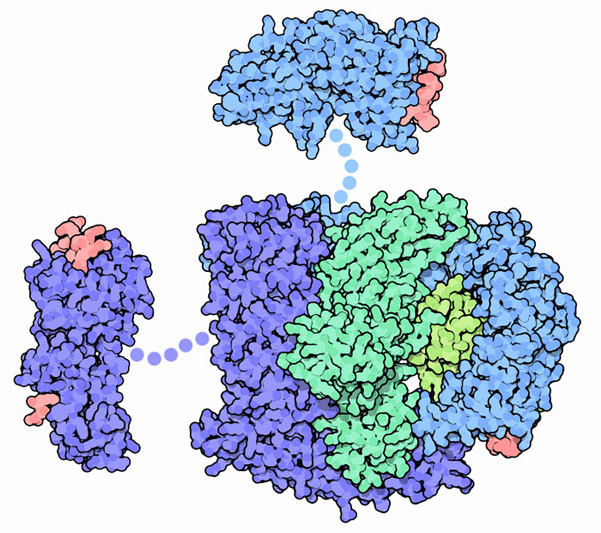
クラスリンは膜に直接結合して小胞を作るということはしない。その代わり、細胞膜表面にある分子を認識するアダプタータンパク質と結合する。少なくとも20種類のクラスリンが特定されており、それぞれが小器官ごとに特有な膜タンパク質とリン脂質にを認識して結合する。このように、アダプターは特定の膜構成要素を小胞に変えて飛び出させる(出芽する)際中心的な役割を果たしている。一例がここに示したアダプタータンパク質の1つ AP-2 (PDBエントリー 2vgl)で、細胞膜にあるリン脂質の一種に弱く結合する(右下にある赤い分子はこのような脂質の一部分)。AP-2 が一旦膜に付加されると、形を変えて膜貫通タンパク質に対して強力な親和性を持つようになる。この膜貫通タンパク質は細胞質側に出ている末端に独特のAP-2特異的なアミノ酸配列を持っている。AP-2 はそれぞれの三脚の脚にも結合してクラスリン被覆を膜表面に集める。そしてかごの形成や解体を助けている修飾タンパク質に結合する。図の上(PDBエントリー 1ky7)と左(PDBエントリー 2g30)に結合した2つの添加分子が AP-2 が持つ特有のアミノ酸配列に結合する。類似タンパク質である AP-1 の構造も、PDBエントリー 1w63とPDBエントリー 1gyuで見ることができる。
構造を見る
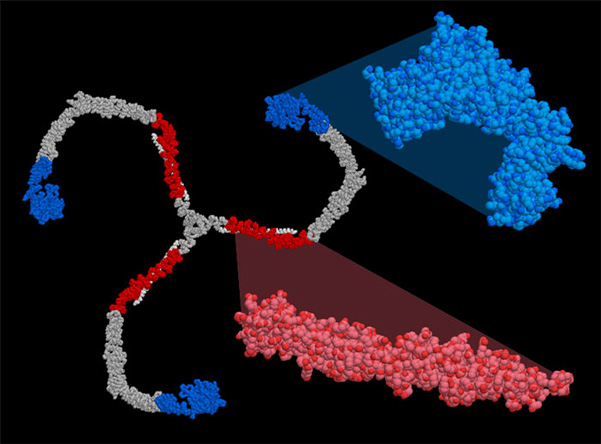
リボソームと同様に巨大で柔軟性のあるクラスリンは結晶化するのが難しい。そこでさまざまな低分解能視覚化技術を使ってクラスリンの構造は決定された。PDBエントリー 1xi4の場合、研究者は2つの断片に関する情報からとりかかった。まず、クラスリンを非晶質(アモルファス、amorphous)の中で凍結させ、クライオ(低温)電子顕微鏡を使って個々のクラスリンかごの電子顕微鏡写真を何千枚も撮って平均した。次に、結晶解析によって解かれた2断片の原子構造(右下・赤:PDBエントリー 1b89と 右上・青:PDBエントリー 1bpo)を3次元画像にあてはめた。欠けている部分の原子模型は類似タンパク質との比較(ホモロジーモデリング)によって作られた。この方法が使えるのは、クラスリンのアミノ酸配列が高度に保存されているからである。構造は密度マップに当てはめ、既知のアミノ酸配列と一斉に合わせるという方法で構造の末端を単純に結合した。
"clathrin" のキーワードでPDBエントリーを検索した結果はこちら。
クラスリンについてさらに知りたい方へ
当記事を作成するに当たって用いた参考文献の一部を以下に示します。
- T. Kirchhausen (2000) Clathrin. Annual Review of Biochemistry 69 , 699-727.
- B. Alberts, A. Johnson, J. Lewis, M. Raff, K. Roberts and P. Walter (2002) Molecular Biology of the Cell. Garland Science , San Francisco .
- S. A. Mousavi, L Malerod, T. Berg and R. Kjeken (2004) Clathrin-dependent endocytosis. Biochemical Journal 377 , 1-16.
- D. Owen, B. Collins and P. Evans, (2004) Adaptors for clathrin coats: structure and function. Annual Review of Cell and Developmental Biology 20 , 153-191.
- T. D. Pollard and W. C. Earnshaw (2004) Cell Biology . W.B. Saunders , Philadelphia .
- S. Honing, D. Ricotta, M. Krauss, K. Spate, B. Spolaore, A. Motley, M. Robinson, C. Robinson, V. Haucke and D. J. Owen (2005) Phosphatidylinositol-(4,5)-bisphosphate regulates sorting signal recognition by the clathrin-associated adaptor complex AP2. Molecular Cell 18 , 519-531.
- J. Wilbur, P. Hwang and F. Brodsky (2005) New faces of the familiar clathrin lattice. Traffic 6 , 346-350.
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









