89: アコニターゼと鉄調節タンパク質1(Aconitase and Iron Regulatory Protein 1)
アコニターゼはトリカルボン酸回路(TCA回路、クエン酸回路)に欠かせない酵素で、鉄制御タンパク質1はメッセンジャーRNAと相互作用し細胞内の鉄濃度を制御するタンパク質である。あなたはこのように尋ねるかもしれない。この2つのタンパク質にどのような共通点があるのかと。この2つのタンパク質は別々の研究者によって発見され研究されたもので、それぞれが持つ互いに大きく違った機能を示す名前が付けられている。ところが驚くべきことに、この2つのタンパク質のアミノ酸配列を見ると、同じであることが分かった。同じタンパク質が非常に異なる2種類の仕事をしているのである。
アコニターゼ...
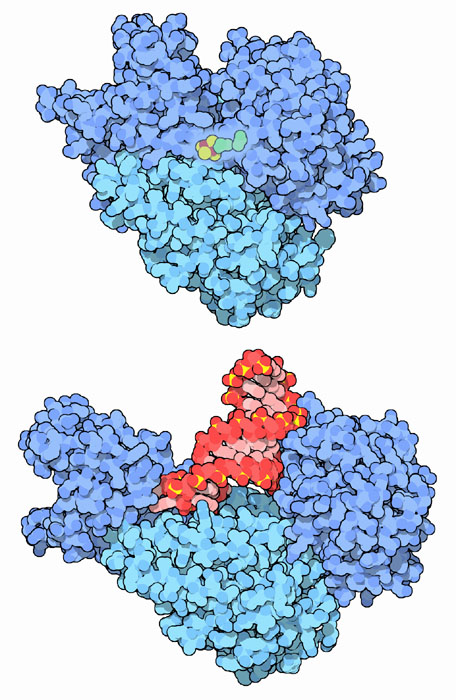
アコニターゼ酵素はエネルギーを作り出す中心的反応において重要な役割を果たしている。トリカルボン酸回路の途中で、この酵素はクエン酸をイソクエン酸に変換する。アコニターゼの1つの型が、私たちの持つミトコンドリアで見られる。ここではクエン酸回路のほとんどが行われる。一方類似の型が細胞質で見られ、ここでは他の合成作業に使われるイソクエン酸が作られる。右図上に示したのが細胞基質型の構造で、PDBエントリー 2b3y のものである。このタンパク質は複数のドメインで構成された1本のペプチド鎖でできている(ドメインは青の濃さを変えて区別し示している)。ドメインはくるみ割りのように閉じて活性部位を取り囲んでいる。その活性部位には鉄硫黄クラスターがあって反応を助けている。
...それとも鉄制御タンパク質1
アコニターゼの細胞基質型は鉄制御タンパク質1としても働く。右図下の構造はPDBエントリー 2ipy のもので、どのようにして完全に別の機能を果たしているかを示している。アコニターゼの中にある鉄硫黄クラスターは不安定で、外れる時に時々交換しなければならない。細胞内の鉄濃度が低くなると、鉄硫黄クラスターを再生成するだけの鉄が不足し、アコニターゼは第2の機能を行うよう変化する。タンパク質は開き、特有のメッセンジャーRNA分子の中にあるヘアピンループをつかむ。これにはフェリチン(ferritin)のメッセンジャーRNAの開始部位にあるヘアピンと、トランスフェリン受容体(transferrin receptor)のメッセンジャーRNAの末端にある似た5つのヘアピンが含まれる。鉄制御タンパク質1が結合すると、フェリチンの形成が阻害されて鉄の蓄積が減少し、トランスフェリン受容体の構築が促進される。その結果、細胞は血液からより多くのトランスフェリンを取り上げ、同時により多くの鉄を取り込むことになる。
副業をするタンパク質
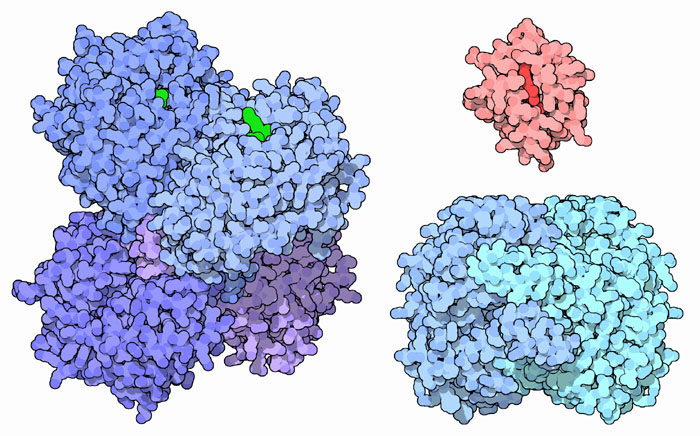
他にも、2種類の完全に違った機能を持ち2倍の一生を送っているタンパク質はたくさんある。ここにはそのような例を3つ挙げる。レチナール脱水素酵素(retinal dehydrogenase)は光感受性のレチナールを制御分子であるレチノイン酸(retinoic acid)に変換する。上図左に示したのはこの酵素に補因子であるNADH(緑)が結合したPDBエントリー 1o9jの構造である。このタンパク質の2つ目の仕事は眼球の密度と吸光度を調整することで、この仕事をする時はエタクリスタリン(eta-crystallin)と呼ばれる。上図右上に赤で示したのが、PDBエントリー 3cyt のチトクロムc(cytochrome c)である。このタンパク質は、ミトコンドリアにおいて電子を運搬するというエネルギー産生においてよく知られた役割を果たしている。ところが、細胞が損傷すると、チトクロムcは細胞質へと放出され2つ目の仕事を行う。その仕事は、プログラムされた細胞死(アポトーシス)につながる一連の反応を開始させるというものである。3つ目の副業をするタンパク質は上図右下に示した[[mom:050_02|リン酸グルコース異性化酵素]](phosphoglucose isomerase、PDBエントリー 2pgi)で、解糖系を進める10個の酵素のうちの1つである。この酵素は細胞外にも分泌されて、細胞信号伝達物質として機能する。その場合は、ニューロロイキン(neuroleukin)、自己分泌可動性因子(autocrine mobility factor)、分化成熟仲介物質(differentiation and maturation mediator)といういくつかの名前で呼ばれる。これらの名前から、細胞間で特定の信号を輸送することが分かる。
構造を見る
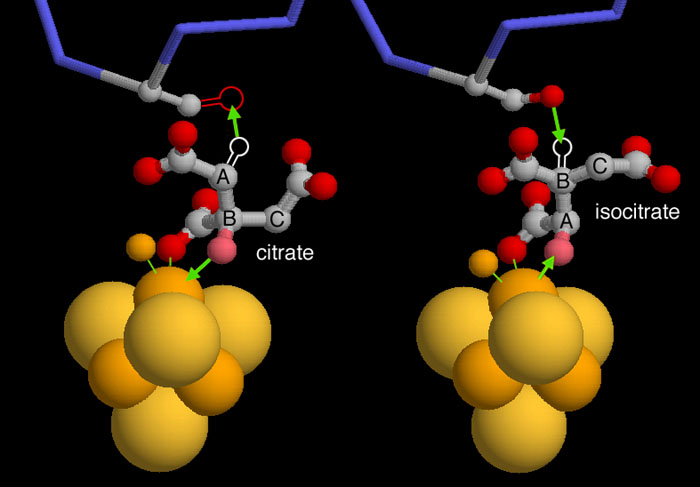
アコニターゼは、生化学の教科書で例としてよく使われる古典的で立体特異的な反応を行う。クエン酸からヒドロキシル基(-OH)と特有の水素原子を取り出し、立体化学的に正確な方法で入れ替えてイソクエン酸を作る。この反応は2つの結晶構造によって明らかにされたが、これを見るに当たって少し想像力を働かせる必要がある。なぜなら結晶構造には水素原子の位置情報は含まれていないからである。上図左に示したPDBエントリー 1c96の構造では活性部位にクエン酸が結合している。この酵素は通常型の場合、酸素原子(ピンク色)が鉄硫黄クラスターによって、水素原子が上にあるセリンによって取り出される(両反応を緑の矢印で示した)。但し、この構造はセリンがアラニンに置き換わった変異体であるため、セリンでは存在するはずの酸素原子がみられない。2つ目の反応では、上図右に示したPDBエントリー 7acnのように、分子が反転して上下が逆になり(A-B-C と標識された位置が変わっているのに注意)、水素とヒドロキシル基が異なる場所に付け戻されてイソクエン酸ができる。
"aconitase" と "iron regulatory protein" のキーワードでPDBエントリーを検索した結果はそれぞれリンク先をご参照ください。
アコニターゼと鉄制御タンパク質1についてさらに知りたい方へ
当記事を作成するに当たって用いた参考文献の一部を以下に示します。
- 2006 The double life of aconitase. Structure 14 2-4
- 2006 The role of iron regulatory proteins in mammalian iron homeostasis and disease. Nature Chemical Biology 2 406-414
- 2004 Molecular mechanisms of multitasking: recent crystal structures of moonlighting proteins. Current Opinion in Structural Biology 14 663-668
- 2003 Enzymes with extra talents: moonlighting functions and catalytic promiscuity. Current Opinion in Structural Biology 7 265-272
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









