64: キネシン(Kinesin)

細胞は大変小さいので、多くの分子過程では別の場所から材料を得るのに単純なランダム拡散(random diffusion)を使う。例えば、グルコース(glucose)分子が解糖(glycolysis)で分解される時、10種類の酵素と全ての中間産物はまとめて細胞質に放出され、辺りをランダムにはじきとばされ、全てがなんとかその適切な場所を見つける。ランダム拡散は、低分子やタンパク質が仕事を行うには十分な速さがあるが、より大きな仕事を行うには十分ではなく、細胞がより積極的な働きかけを行う必要がある。ここが分子モーターの出番となる。細胞は大きな分子標的を適切な場所へと引っ張っていく様々なモーターを作っている。
分子モーター
細胞はATPの動力によってタンパク質の線維(filament)に沿って動く3種類のモーターを作る。私たちの筋肉に動力を与えるのに使われるミオシン(myosin)はアクチンフィラメント(actin filament)に沿って動くのにATPのエネルギーを使う。一方、キネシンとダイニン(dynein)は微小管(microtubule)に沿って移動し、積み荷を運んでいく。これらのモーターは通常ATPを分割してエネルギーを動きに変換するモータードメイン(motor domain)と、移動対象に結合する積み荷結合ドメイン(cargo-binding domain)とで構成されている。ここに示したキネシン(PDBエントリー 3kin)は2つの鎖からできている。2つのモータードメインは上部にあり、赤で示したADPを伴っている。長くて柔軟な柄の部分はモータードメインと下にある積み荷結合ドメインをつないでいる。分子の下の部分はこの図では模式的に示している。なぜなら、モータードメインと柄上部の小さな根本部分しかこの結晶構造では見えていないからである。
レールに乗る
キネシンは細胞内で多くの仕事に使われている。通常の細胞は微小管の並びを持っていて、いずれも細胞の中心から表面へ向けて伸びている。キネシンはリソソーム(lysosome)や小胞体(endoplasmic reticulum)のように大きな対象物を核(nucleus)から出して表面へと動かすのに用いられる。一方ダイニンは、ものを内に引っ張ってくる逆の機能に用いられる。キネシンは非常に長い神経軸索(nerve axon)にそって材料を引っ張っていくが、この機能でキネシンは発見された。またキネシンは微小管を隣へと移動させるのにも用いられる。これは例えば、細胞分裂で染色体(chromosome)を分けるのに2つに分かれた微小管の系を作る過程において見られる。
一歩ずつ進む
キネシンとミオシンは異なった方法でその機能を実行する。ミオシンはアクチンフィラメントに手を伸ばして動力を生みだし、すぐにフィラメントを手放す。だから、長い距離を動くには多くのミオシン分子が一緒になって働き、それぞれの部分を分担しなければならない。一方キネシンは、全て自力で仕事を行うことができる。キネシンは微小管をたぐってのろのろ進んでいく。歩みを進める各段階において、一方のモータードメインはしっかり微小管をつかんでいて、その間にもう一方のモータードメインが離れて次の一歩を踏み出し、微小管を次の場所をつかむ。このように2つのモータードメインが協力して、一歩8ナノメーター(nm)の歩幅で止まるまでに数百歩、微小管に沿って動く。なお、キネシンが動いている様子の映像を http://www.scripps.edu/cb/milligan/projects.html で見ることができる。
こっち? それともあっち?
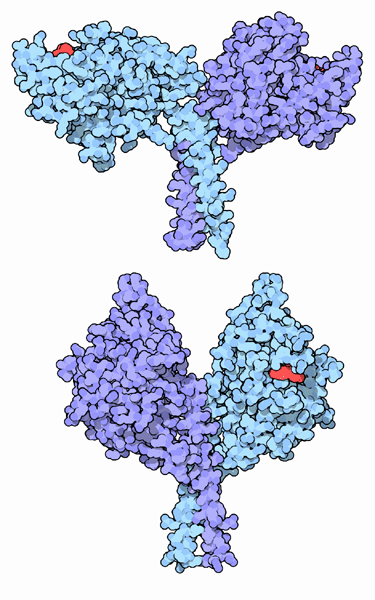
私たちの細胞はそれぞれ機能が異なる約40種類のキネシンを作る。そしていずれも動力を生み出すのにATPを使う似たモータードメインを持っている。しかしこのモーターは、移動する必要がある対象物にモーターをくっつける様々な種類のアダプターに付加される。ここでは2種類のキネシンを示した。上に示したのは標準的なキネシン(PDBエントリー 2kin)、下に示したのはncd(PDBエントリー 2ncd)である。2つのモータードメインが異なった方法で柄に接続されていることに注目して欲しい。この違いは、2つのキネシンが互いに反対方向に微小管の上を動くという結果を生み出している。
構造をみる
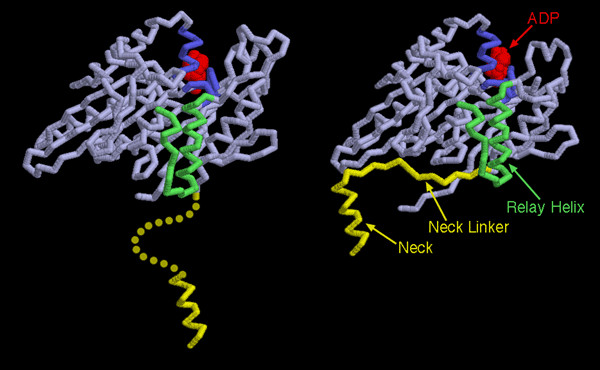
いくつかの分子モーターの構造が決定されてきたので、今では動力を与えられて動く動きの機構が異なるキネシンの間でもよく似ており、またそれはミオシンにもそのことがよく当てはまることが分かる。分子モーターが使う方策は、ATPのリン酸間結合の切断という小さな変化をモーターの大きな構造変化に連携させるというものである。ここには2つのキネシンを示した。左の分子は力をかけて動く前のキネシン(PDBエントリー 1bg2)、右の分子は力をかけて動いた後のキネシン(PDBエントリー 2kin)である。いずれの場合も、一方のモータードメインとADP(赤色の分子)だけが示されている。青で示したATP結合部位は、ATPが切断され、リン酸が解離することによってわずかに変化する。この小さな変化によって緑色で示した中継らせん(relay helix)が押され、形状のわずかな変化が引き起こされる。これにより柄の接続部位(neck linker、黄色の部分)が入る完璧な窪みが作られる。力をかける前の窪みは小さすぎ、接続部位は柔軟で決まった構造をとらない(disordered)。一方力をかけた後は、窪みが接続部位にとってタンパク質の中へ入るのにちょうど良い大きさとなり、柄の根本およびくっついた積み荷を引っ張っていく。
更に知りたい方へ
以下の参考文献もご参照ください。
- 2000 The Way Things Move: Looking Under the Hood of Molecular Motor Proteins. Science 288 88-95
- 2000 Walking on Two Heads: the Many Talents of Kinesin. Nature Reviews Molecular Cell Biology 1 50-58
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









