50: 解糖系酵素(Glycolytic Enzymes)
グルコース(ぶどう糖)は身体全体の細胞に力を供給している。グルコースは安定で水に溶ける物質であるため、燃料分子として使いやすく、血液を通して貯蔵場所から必要とされている場所へ簡単に運ぶことができる。グルコースは化学エネルギーが閉じ込められており、いつでも取り出すことができる。試験管内で、グルコースを燃やすと二酸化炭素と水、そして大量の光と熱が生成される。私たちの細胞内でもグルコースを燃やしているが、よく制御された多くの細かい段階を経て行われているので、ATP(アデノシン3リン酸)などのより使いやすい形でエネルギーを得ることができる。解糖系(糖分解)はグルコースを細胞内で燃焼させる最初の反応過程なのである。
糖の分解
解糖系はグルコースに始まり、10段階に分けて少しずつ化学的変換が行われる。この反応過程では、糖分子には2つのリン酸があらかじめ付加される(これには2分子のATPが使われる)。そして分子は2つに分割され、最終的に分子は作り直され水分子が除去されて、4つのATP分子がつくられる。解糖系反応全体をみると、この部分的な糖の分解反応によって新たに2分子のATPを作り出していることになる。このATPはあらゆる細胞で分子反応過程のエネルギー源として使われる。さらに解糖系反応中の一段階で4原子の水素も取り出されるが、これは生合成や更なる化学的エネルギーを作り出すのに使われる。
解糖の後
解糖系6番目の酵素は糖から水素原子を取り除き、それを小さな輸送分子NAD(ニコチンアミドアデニンジヌクレオチド nicotinamide adenine dinucleotide)に移す。そこでもし解糖系の全過程が進行中であれば水素は貯まって行く一方なので、細胞はこれを処理して帳尻を合わせる方法をいくつか作り出した。多くの細胞が利用しているのは、私たちが持つ細胞のほとんども含め、最終的にできた水素を酸素と結合させて水を作り、その際大量のATPを追加生産する方法である(今月の分子5番:チトクロムc酸化酵素(cytochrome c oxidase)参照)。一方酵母細胞は別の酵素(今月の分子13番:アルコール脱水素酵素(alcohol dehydrogenase))を使って水素原子を分解した糖分子に戻し、アルコールをつくって細胞外に排出するという方法を使う。ビールやワインを飲む時はいつも、こうして作り出されたアルコールを飲んでいるのである。また筋肉を酷使すると、収縮するのが速すぎて十分な酸素を取り込むことができなくなり、酵母とは別の方法で水素原子を糖に戻し、乳酸を作り出す。無酸素運動をすると、この乳酸が溜まり、後で酸素が使える時に分解しなければならなくなる。
完全な10
解糖系に関する興味はつきない。これら10種の酵素の中には、私たちの細胞にエネルギーを与えている重要な分子反応過程の事例がいくつもあることが分かるだろう。それらの酵素は、原子の追加、除去、移動などを間違いなく行う様々な化学的作業を素早く効率的に行うために進化し完成されたものである。反応経路は注意深く調整され、グルコースはエネルギーが必要な時にだけ分解されるようになっている。解糖系の中には、機能する際に形状が変化するアロステリック酵素(他の分子によって活性制御を受ける酵素)があることも分かるだろう。その中には、反応する時は基質と共有結合を形成するものや、金属イオンや有機分子の助けを借りるものがある。中には、非常に効率的に働き、糖分子よりも速くそのような補助分子を取り込んでしまう酵素もある。反応経路全体は、スムーズでしかも暴走することがないように各段階は調整され、糖を壊してエネルギーを取り出す目的に向かっているのである。
1:ヘキソキナーゼ(Hexokinase)
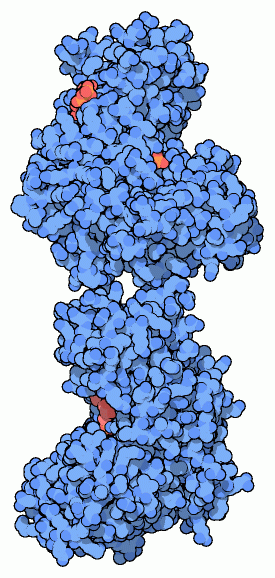
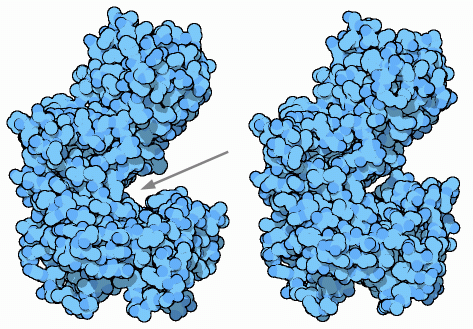
ヘキソキナーゼ(hexokinase)は、解糖系の最初の段階を進める酵素で、ATP分子を使って反応を開始させる。この酵素はリン酸をATPからグルコースに移し、グルコース-6-リン酸を作り出す。ダニエル コシュランド(Daniel Koshland)は酵素の構造が明らかになる10年前に、次のことを示した。まずこの化学反応は水から隔離されている必要があり、それによって、ATP分子が水分子によって加水分解されてリン酸になるのを防いでいる。そして、ヘキソキナーゼはATPとグルコースの周りに接近して取り囲み、この2つを結合させている。1970年代、酵母のヘキソキナーゼの構造がいくつか解明されて、この説は正しいことが示された。ヘキソキナーゼは留め金のような形をしていて、一方の側面に大きな溝を持っている(下図の矢印で示した部分)。下図左に示した構造はグルコースを含まない、PDBエントリー 2yhxのものである。開いた構造をしており、活性部位に接触することができる。ところが、グルコースが結合すると、下図中央に示したPDBエントリー 1hkgのように構造は閉じてグルコースは囲まれてしまう。これら2つの構造はヘキソキナーゼのアミノ酸配列が分かる前に解明された不完全な構造である。より最近になって分かった構造を見るには、PDBエントリー 1ig8(開いたグルコース非結合型)、PDBエントリー 1bdg(閉じたグルコース結合型、住血吸血由来)を参照のこと。
よくあることだが、ヒトの持っている型を見ると、事はより複雑になる。私たちは何種類かのヘキソキナーゼを作って、細胞によって少しずつ異なる要求に合わせている。右図に示したのは脳細胞から得られたPDBエントリー 1dgkの構造である。これは酵母が持つヘキソキナーゼの倍の大きさがあり、驚くべき事に2個の酵母のヘキソキナーゼの頭部と尾部をつないだような構造をしている。どちらの部分もほとんど同じ活性部位を持っているが、下半分は触媒反応に特化しており、一方上半分は制御に特化していてリン酸転移反応は行わない。
2:リン酸グルコース異性化酵素(Phosphoglucose Isomerase)
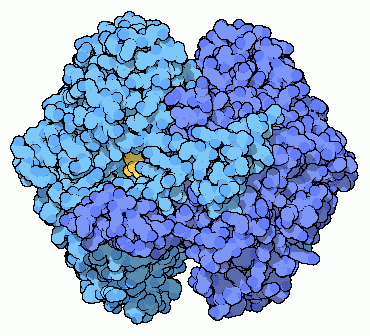
解糖系の2番目の段階は異性化である。この反応は1つの分子の形を変化させるが、いかなる原子の付加や除去も行わない反応である。ここに示したのはPDBエントリー 1hoxのリン酸グルコース異性化酵素(phosphoglucose isomerase)の構造で、グルコース-6-リン酸(glucose-6-phosphate)を取り込みいくつかの原子を動かしてフルクトース-6-リン酸(fructose-6-phosphate、黄色で示した分子)を作り出す。この酵素はどちらの方向にも反応を進めることができる。そのためこの酵素は、グルコース-6-リン酸が細胞内に豊富に存在するときはこれをフルクトース-6-リン酸に変換し、フルクトース-6-リン酸の方が多くなると逆方向への変換を行うようになる。
最近、この酵素が細胞の外で、酵素としてではなく分子信号伝達物質として別の重要な役割を果たしていることが発見された。この酵素は白血球から分泌され、様々な種類の細胞が成長や動きの制御を行うのを助けている。研究者たちがヒトのゲノムを徹底的調べた結果、身体のある場所である機能を果たしているタンパク質が他の場所では全く別の役割を果たしているという「兼業」タンパク質が他にもたくさん見つかった。
3:リン酸フルクトースリン酸化酵素(Phosphofructokinase)
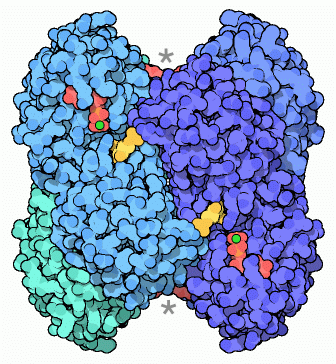
解糖系の第3段階は、解糖系制御における重要な箇所となっている。グルコース-6-リン酸とフルクトース-6-リン酸が解糖系最初の2段階で作られ、別の細胞内反応過程で使われる。ところが、リン酸フルクトースリン酸化酵素(Phosphofructokinase)が、2つ目のリン酸を糖に追加すると、糖は完全に分解される。リン酸フルクトースリン酸化酵素は、いろいろな分子の濃度を検知し、糖を分解するタイミングを決定する分子コンピュータ模型のようである。例えば、ADPとAMPが主に存在する状態では、この酵素のスイッチが入って細胞はATPを作る。リン酸フルクトースリン酸化酵素は動く部分を持つ機械的コンピュータである。右に示した細菌の酵素(PDBエントリー 4pfk)は、同じサブユニットが4つ集まった構造をしている。一方私たちの細胞が持つ酵素はこれより大きくて複雑である。活性部位には黄色で示した糖と、赤色で示したATPが結合している(実際の構造はADPが結合していて、緑で示したマグネシウムイオンを伴っているものである)。糖結合部位が2つの別々のサブユニットから構成され、糖分子のそれぞれの側をとりかこんでいる様子に注目して欲しい。またこの酵素には上下にも制御用結合部位がある。右図のアスタリスクで示した位置がその場所で、ここに別のADP分子が結合しているのが分かるだろう。下図に示したのは酵素を側面から見たもので、ADPなどの分子が制御部位に結合すると酵素全体の構造が変化する。左側が活性状態を示したPDBエントリー 4pfkの構造で、右側が不活性状態を示したPDBエントリー 6pfkの構造である。酵素の構造が変化すると、活性部位の形も変わって酵素のスイッチが入ったり切れたりするのである。
ヒント:PDBエントリーの中でリン酸フルクトースリン酸化酵素の構造を探す時は、4つのサブユニット全てを含んだ生物的単位全体をダウンロード対象にしていることを確かめて欲しい。
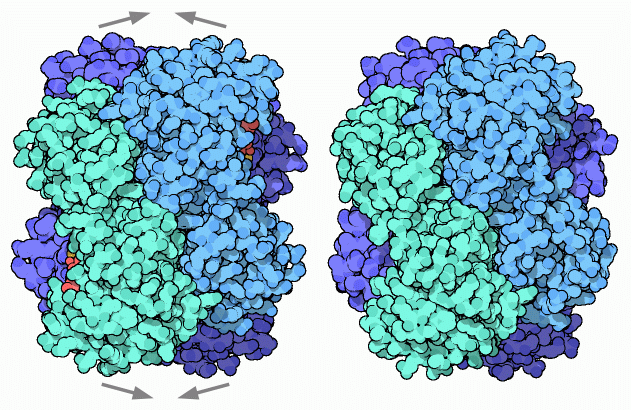
4:フルクトース1,6-2リン酸アルドラーゼ(Fructose1,6-bisphosphate Aldolase)
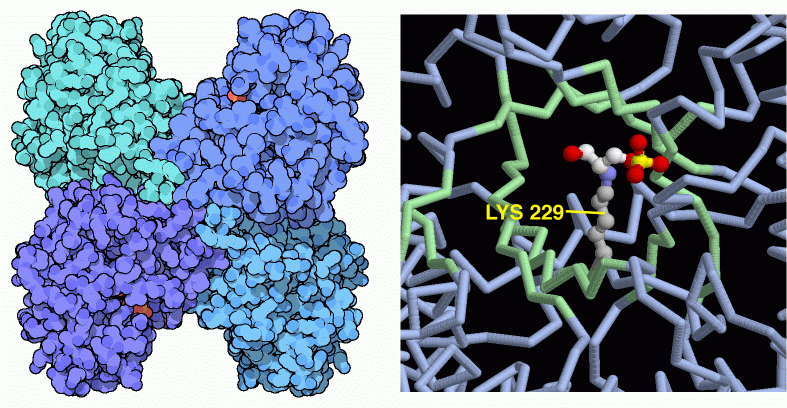
解糖系において、この段階では糖分子に印がつけられ、細胞が糖を分解する準備ができる。4つ目の酵素であるフルクトース1,6-2リン酸アルドラーゼ(fructose1,6-bisphosphate aldolase)は糖分子を真ん中で切断し、似た2つの断片にする。できた各断片にはそれぞれリン酸が1つずつ付加されている。この酵素は逆方向への反応、すなわち2つの小さな分子からリン酸化されたフルクトースを再構成することもできる。実際、この酵素の名前はこちらの逆方向への反応であるアルドース縮合から名付けられたものである。ここに示したのは PDBエントリー 4ald から得られた酵素で、私たちの筋肉細胞で見いだされたものである。同じサブユニット4つから構成されており、それぞれが活性部位を持っている。この特別な型では、活性部位に独特ななリジン残基〜Lys229〜があり、糖鎖に攻撃する。上図右に示したのは PDBエントリー 1j4e から得られたもので、このリジンは分裂反応において糖分子と共有結合を形成する。この構造は糖分子が分裂し、活性部位にはその片方だけが残っている状態で凍結されたものである(赤は酸素、白は炭素、黄色はリン原子を示す)。
ほとんどの細菌が使うアルドラーゼ酵素は、私たちの細胞が持つアルドラーゼとは異なっている。特別なリジンアミノ酸の代わりに2つの金属イオンを使っている。細菌のアルドラーゼの例は PDBエントリー 1zen で見ることができる。その際、金属イオンを見るのを忘れないように。また、温泉古細菌がつくる普通みられない酵素(PDBエントリー 1ojx)も見て欲しい。この酵素は、私たちのもつ酵素と同じく活性部位にリジンを使っているが、10本のポリペプチド鎖で巨大な分子複合体を形成している。
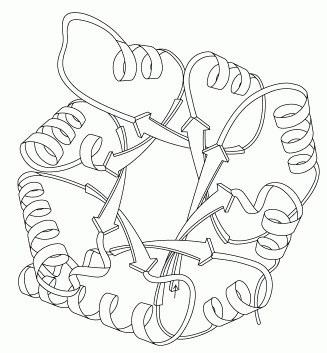
5:3炭糖リン酸異性化酵素(Triose Phosphate Isomerase)
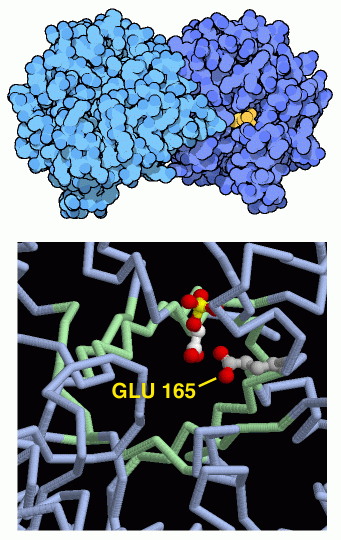
解糖系のこの段階で、細胞は糖を2つの異なる分子へと分解する。節約を考えると、それぞれの物質が別々の反応経路で生成されるのではなく、1つの反応経路でできることは理想的なことである。この5番目の段階で、2つの分子を相互変換することによってこれが可能となる。右図に示すのは、PDBエントリー 2ypi から得られた3炭糖リン酸異性化酵素(triose phosphate isomerase)の構造で、炭素原子から水素原子を引き離し、隣の炭素原子と置き換える。右図下のRasMolで作った図で、特別なグルタミン酸(Glu165)がこの転移反応を行っていることを示している。3炭糖リン酸異性化酵素は完全な酵素として記述されてきた。この酵素があると、ない時の何十億倍もの速さで反応が行われる。その速度は大変速いので、分子が酵素をどれだけ速くとらえることができるかによって反応速度は決定されている。
自分でこの構造を見る時は、活性部位が「βバレル」の中央にあることにも注目して欲しい。βバレルはまっすぐな鎖が筒状に並んでできる構造で、右図下のRasMol図では緑色で示している。下図はジェーン・リチャードソン(Jane Richardson)によって描かれたもので、タンパク質に含まれる鎖の折りたたみ様式を示している。これによると、内側にあるまっすぐなβ鎖でできた環は、αらせんでできた外側の環によって囲まれていることが分かる。この外側のバレル(環)を構成するらせんが、隣のらせんとどのようにつながっているかに注目して欲しい。10個の解糖系酵素の構造を見る際、他にもこのように美しい折りたたみ様式をとって構築された酵素があることにも注意して欲しい。
6:グリセルアルデヒド-3-リン酸脱水素酵素(Glyceraldehyde-3-phosphate Dehydrogenase)
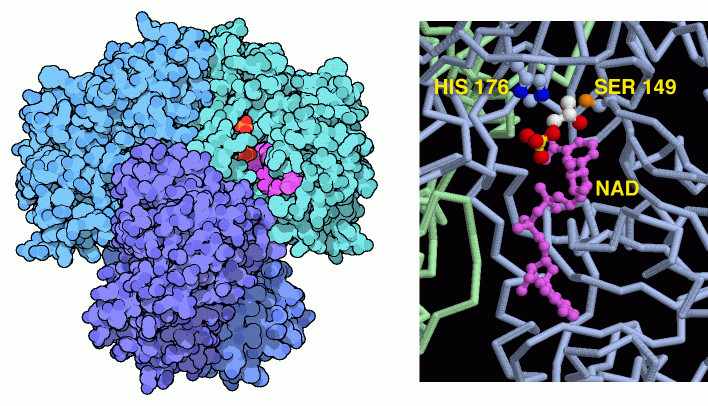
解糖系の半分までやってきて、ついに細胞はエネルギーを取り出し始める準備ができた。6番目と7番目の段階で、細胞は新たなリン酸を分子に追加し、それを2分子のATP分子を作るのに使う。グリセルアルデヒド-3-リン酸脱水素酵素(Glyceraldehyde-3-phosphate dehydrogenase)は、1分子のリン酸を取り込んで分子に結合する。この過程で、水素輸送分子NAD(図中の赤紫色の分子)を使って2分子の水素原子も取り出している。最初のページで述べたように、これらの水素原子は酸素呼吸の反応過程でさらにエネルギーを作り出すのに使われるか、またはいくつかの方法を経て分解された糖分子に戻される。
グリセルアルデヒド脱水素酵素は4つの同じサブユニットから構成されている。PDBに登録されているこの酵素の多くは、4つの活性部位全てにNADが結合し、さらに2分子のリン酸イオンか硫酸イオンが結合した構造をしている。上図左に示した、ヒト由来の PDBエントリー 3gpd はその一例である。イオンの一方は糖分子のリン酸基が占めている場所に結合し、もう一方は反応で入ってくるリン酸の位置する場所に結合すると考えられている。PDBエントリー 1nqo の構造は、基質分子が結合した反応の最初の段階をとらえたものである。その後、近くにあるシステインアミノ酸が基質分子に攻撃し、炭素原子と結合を形成する。結合はリン酸が付加されると切断される。この構造では、研究しやすいようシステインは活性の低いセリンに変更されている。また基質近くにあるヒスチジン残基も反応を助けている。
PDBエントリー 1nqo の構造をみる時、適切な生物学的単位をダウンロードしているかを確認して欲しい。主要PDBファイルには4つの鎖に関する情報が含まれているが、これは適切な生物学的4量体ではない。
7:リン酸グリセリン酸リン酸化酵素(Phosphoglycerate Kinase)
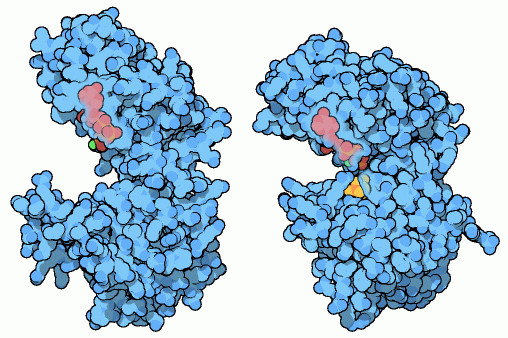
さて、解糖系の7つ目の段階に来て、細胞はATPを作る準備が整った。グルコースは2つの分子に分割され、それぞれの分子にリン酸が付加された。リン酸グリセリン酸リン酸化酵素(リン酸グリセリン酸キナーゼ、phosphoglycerate kinase)はこれらの分子を取り込み、一方のリン酸をADPに移してATP分子を作り出す。この過程は、解糖系の最初の酵素と同じく水から隔離されていないと正しくリン酸を転移することができない。リン酸グリセリン酸リン酸化酵素は、ヘキソキナーゼと同様の方法を使う。つまり、酵素は反応部分に近づいて囲み込み、水分子を遠ざけて接触しないようにしている。この酵素は柔軟な接合部分でつながれた2つの丸い突出部で構成されている。上の突出部はADPに結合し、下の突出部はグルコースの断片(グリセリン酸リン酸)が入る窪みを持っている。そして基質が結合すると、ちょうつがいは閉じて転移が行われる。上図左の分子(PDBエントリー 3pgk)はADPが結合する開いた構造※1、右の分子(PDBエントリー 1vpe)は閉じた構造を示している。
【訳注】
※1:実際このエントリーに含まれる構造は、反応前の構造ではなく反応後に再び開いた構造で、生成物であるATPとグリセリン酸リン酸が結合している。
8:リン酸グリセリン酸ムターゼ(Phosphoglycerate Mutase)
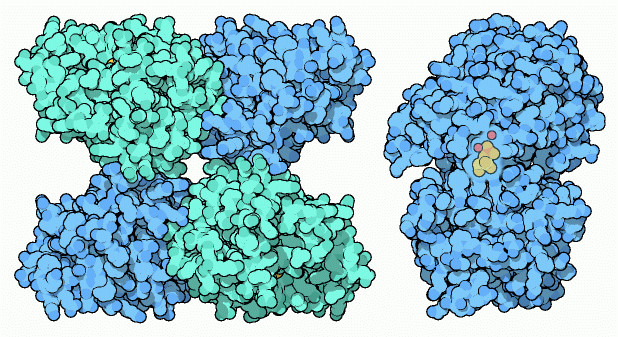
解糖系最後の3段階では、糖を2分した分子から残ったリン酸を取り除き、それを使ってさらに2分子のATPを作る。リン酸グリセリン酸ムターゼ(phosphoglycerate mutase)は、リン酸を分子の端から中心の重要な場所へと移動させることによってエネルギーの最終的な取り込みを始める。この酵素はいくつかの型がある。上図左に示したのは酵母の持つ酵素(PDBエントリー 3pgk)で4個の同じサブユニットが集まってでできている。私たちの酵素もこれと似ているが、サブユニットの数は2つだけである。植物や多くの細菌は全く異なる型の酵素を作り、その反応にはマンガン(Mn)を用いる。上図右に示したのはその一例(PDBエントリー 1eqj)である。
私たちの細胞にあるこの酵素は、右図に示した細菌の酵素(PDBエントリー 1e58)と同じように特別なヒスチジン アミノ酸を使っている。このヒスチジンはリン酸を取り出して別の場所に戻す役割を担う。実際この酵素は、これとは逆のことをする。つまり先にリン酸1個を分子に追加して2個付加された状態にし、その後もう一方のリン酸を取り外している。この反応を行うには、酵素に前もって追加のリン酸分子を補充しておく必要がある。小さな中間体分子である2,3-二リン酸グリセリン酸は、これらの反応性に富むリン酸を酵素に渡す。酵素にリン酸が補充された後、1、2分の間は活性を保つ(その間忙しく何度も反応を行う)。その活性はリン酸が外れて置き換えが必要になるまで続く。
9:エノラーゼ(Enolase)
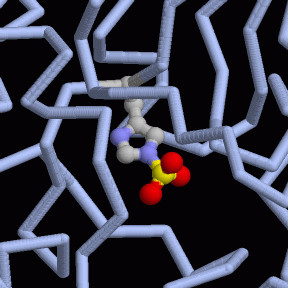
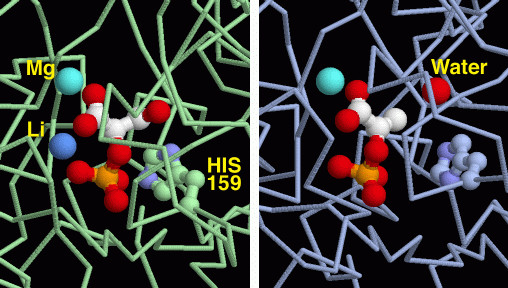
解糖系9番目の段階において、細胞はリン酸を不安定な場所に置き、簡単に取り除いてATPを作れるようにする。エノラーゼ(enolase)酵素は水分子を除去し、分子の炭素骨格内の使いにくい場所に新たな二重結合を形成する。PDBエントリー 2one は珍しく、水除去反応の前後両方の構造を示している。下図に示したように、この酵素は2つの同じ活性部位を持っていて、それぞれ異なる状態をとらえている。下図左は反応前の反応物(2-リン酸グリセリン酸)が結合している状態、右は水分子が取り除かれた生成物(リン酸エノールピルビン酸)が結合した反応後の状態を示している。エノラーゼは反応の際2つの金属イオンを使う。1つは水色で示したマグネシウムイオンである。これは酵素に基質分子をつなぎとめ、適切な場所に保持する働きをする。そしてもう一つのイオンが結合して触媒を助ける。この構造では、リチウムイオンが一方の活性部位に見られる。また完全に置き換えられたヒスチジンもこの反応を手助けしている。
10:ピルビン酸リン酸化酵素(Pyruvate Kinase)
解糖系の最後の段階にきて、細胞はついにATP生産の全量を得る準備ができた。ピルビン酸リン酸化酵素(pyruvate kinase)は残ったリン酸を取り除き、ADPに移して新たにATP分子を作る。またこれによって、不安定で小さな糖断片を安定なピルビン酸分子に変換することができる。ピルビン酸は解糖系を離れ、続いて完全に燃焼されて二酸化炭素と水になる。あるいはアルコールや乳酸のような使い捨て分子に変換される。
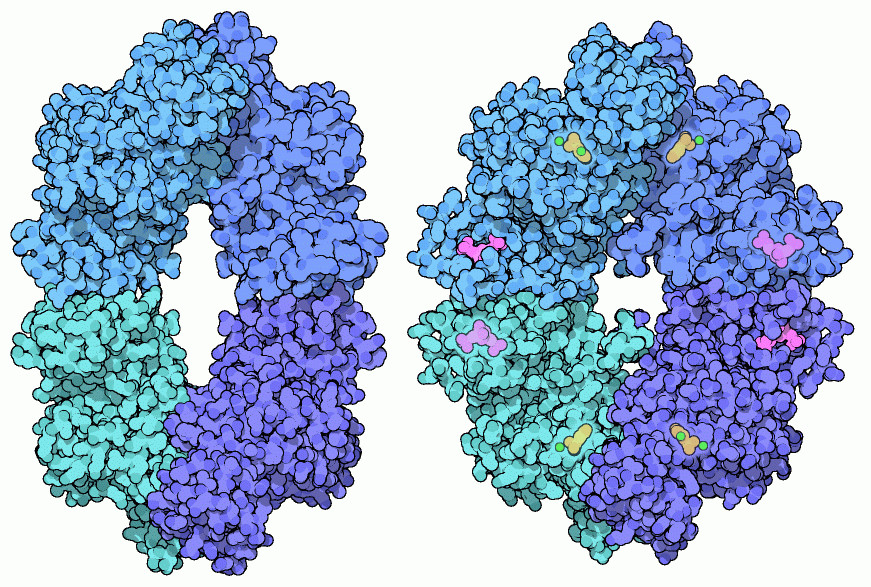
解糖系の出口はピルビン酸リン酸化酵素によって守られ、必要な時だけATPが作られるようにしている。この酵素は、ヘモグロビンと同じのように、反応物の濃度上昇に伴って次第に活性化される。また、リン酸化された糖によっても活性化されるが、この状態は原料が豊富にあることを示している。逆に、細胞内にATPやアミノ酸などのエネルギーとなる分子が豊富にある時は反応が阻害される。ピルビン酸リン酸化酵素はアロステリック酵素(拮抗酵素)で、これら分子の濃度を検知しその結果によって形を変える。この酵素は4つの柔軟なサブユニットで構成されていて、ダイヤモンドのような形に並んでいる。複合体全体は別の分子が結合することによって曲がる。上図において、活性部位は頂上付近と底付近にあって、分かれた制御部位はより中心寄りにある。上図左に示したのは細菌由来の PDBエントリー 1e0u から得られた構造で、不活性な状態を示している。一方右に示したのは酵母由来の PDBエントリー 1a3w から得られた構造で、制御部位に分子(赤紫、フルクトース-1,6-2リン酸)が結合し、曲げられて活性型になっている。活性部位には2つの金属イオン〜ナトリウムイオンとマンガンイオン(どちらも緑色)〜があり、反応を手助けしている。
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









