49: 炭酸脱水酵素(Carbonic Anhydrase)
息を吸うこと、吐くこと
呼吸は生命における基本的な機能であるが、呼吸する時実際に何が起こっているのだろうか。私たちが呼吸で吸い込む空気は、細胞内にある糖と脂肪を分解するために燃料を供給してくれる貴重な酸素を含んでいる。私たちの肺の中で、酸素(oxygen)は血液中に拡散してヘモグロビン(hemoglobin、今月の分子41番)と結合し、身体中のあらゆる細胞へと輸送される。糖と脂肪が分解されると、副産物として二酸化炭素(carbon dioxide)が細胞で生成されるが、これは身体から除去する必要がある。そこで再び血液が輸送媒体としての役割を果たす。二酸化炭素は細胞の外へと拡散し、何種類かの方法で血液中を輸送される。10%未満は血漿(blood plasma)中に溶けて、約20%はヘモグロビンと結合して輸送されるが、大半(70%)は炭酸(carbonic acid)に変換されて肺へと輸送される。赤血球(red blood cell)中には炭酸脱水酵素(carbonic anhydrase)と呼ばれる酵素があって、二酸化炭素を炭酸と重炭酸イオン(bicarbonate ion)に変換する作用を助ける。赤血球が肺に到達すると、同じ酵素が重炭酸イオンを二酸化炭素に戻す変換を助け、できた二酸化炭素は呼吸によって排出される。この反応は酵素がなくても起こるが、炭酸脱水酵素は変換速度を100万倍にまで加速することができる。
緑色植物とサンゴ
植物もエネルギー生産に酸素を使い、二酸化炭素をはき出す。一方緑色植物は日光存在下で水と二酸化炭素を糖に変えることができる。この過程〜光合成(photosynthesis)〜には大気中の二酸化炭素を使う。気体の二酸化炭素は一旦重炭酸イオンとして植物中に蓄えられる。そして陸上植物、水中植物いずれにおいても、炭酸脱水酵素が重炭酸イオンを光合成で使う二酸化炭素に戻す変換を行っている。この酵素が役割を担っているもう1つの興味深い生物現象はサンゴ(coral)の石灰化(calcification)である。海水のカルシウム(calcium)はサンゴポリープ(coral polyp、サンゴの集合体を構成する個体)の炭酸脱水酵素によって作られた重炭酸イオンと反応し、炭酸カルシウム(calcium carbonate)を形成する。これがサンゴの硬い外殻として堆積する。
炭酸脱水酵素
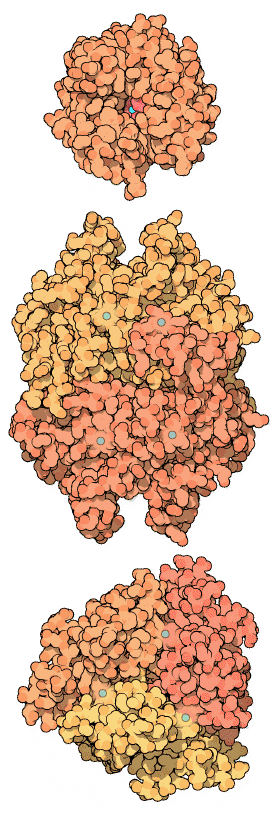
炭酸脱水酵素は二酸化炭素と水から、炭酸、水素イオン(proton)、重炭酸イオンへの変換またはその逆方向への変換を急速に行うのを助ける酵素である。この酵素は1933年、ウシ(cow)の赤血球で初めて同定された。その後、あらゆる哺乳類の組織、植物、藻類、細菌で多数発見されてきた。この古くから見つかっている炭酸脱水酵素には3つの種類(それぞれα、β、γを頭に冠して呼ばれる)がある。この3種類の酵素は、配列や立体構造の類似性は低いが、全て同じ機能を果たし、いずれも活性部位に亜鉛イオン(zinc ion)を必要としている。哺乳類の炭酸脱水酵素はα型、植物の酵素はβ型、温泉に生息するメタン産生細菌の酵素はγ型にそれぞれ属している。このように3種類の酵素はそれぞれ独立に進化して似た酵素活性部位を作ったことは明白である。右図に示したのは上からα、β、γ型の炭酸脱水酵素(それぞれPDBエントリー 1ca2、1ddz、1thj)の構造である。活性部位にある亜鉛イオンは図中に青色で示している。α型酵素は単量体(monomer)であるのに対し、γ型酵素は三量体(trimer)であることに注意して欲しい。一方β型酵素はここでは二量体(dimer)として示されているが、構造中には4つの亜鉛イオンが結合しており、このことは4つの酵素活性部位を持っている可能性を示している。β型に属する他の酵素は四量体(tetramer)、六量体(hexamer)、または八量体(octamer)の形をとっており、このことは二量体がβ型における構成単位となっているであることを暗示している。
哺乳類の炭酸脱水酵素は、存在する組織や細胞内区画によって少しずつ異なる約10種類の型が存在する。このアイソザイム(isozyme、機能が同じで構造が異なる酵素)はある程度配列のばらつきがあって、特有の活性差異を生じている。上述のように、ある筋線維(muscle fiber)で見られる酵素は、唾液腺(salivary gland)で分泌される酵素に比べて活性が低くなっている。ほとんどの炭酸脱水酵素アイソザイムは可溶性で分泌されるものであるが、中には上皮細胞(epithelial cell)の膜に結合しているものもある。なお、遺伝的視点から見た炭酸脱水酵素に関する更なる解説が欧州バイオインフォマティクス研究所(EBI)の「今月のタンパク質」(Protein of the Month)で提供されているので、合わせて参照のこと。
健康と病における炭酸脱水酵素
この酵素は水素イオンと重炭酸イオンを作ったり使ったりするので、私たちの体内で部位によって異なるpHと流動性のバランスを制御する中心的な役割を担う。胃の内壁では酸分泌における役目を果たす一方、この同じ酵素がすい液(pancreatic juice)をアルカリにしたり唾液(saliva)を中性にしたりするのを助けている。腎臓(kidney)や目(eye)における水素イオンと重炭酸イオンの輸送はそれぞれの場所における細胞の含水量に影響する。このように炭酸脱水酵素のアイソザイムは場所によって異なる機能を果たしているので、この酵素が無くなったり機能不全に陥ったりすると、胃における酸産生不全から腎臓の障害まで広がる病気の状態を引き起こしうる。
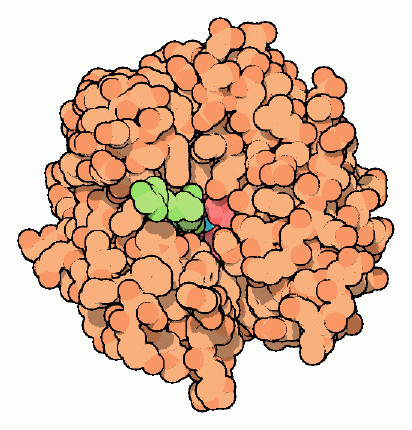
目の形を維持する流動体が蓄積すると、流動体は目の視神経を圧迫して傷つけるかもしれない。このような状態は緑内障(glaucoma)と呼ばれる。近年、炭酸脱水酵素の阻害剤は緑内障の治療に用いられている。この酵素を阻害することにより、緑内障患者の目における流動体の釣り合いが変化し、流動体の蓄積を減らして、眼圧を下げる。PDBエントリー 1cnw の構造は、どのようにして阻害剤(スルホンアミド sulfonamide、図中緑色の分子)がヒトの炭酸脱水酵素(アイソザイムII型)に結合しているのかを示している。この阻害剤が活性部位の近くに結合し、水が亜鉛イオンと相互作用するのを阻害して、酵素の活性を妨げているのに注目して欲しい。残念ながら、この薬を長く使い続けると他の組織にある同種の酵素に影響し、腎臓や肝臓(liver)への障害といった副作用を引き起こしてしまう。
構造をみる
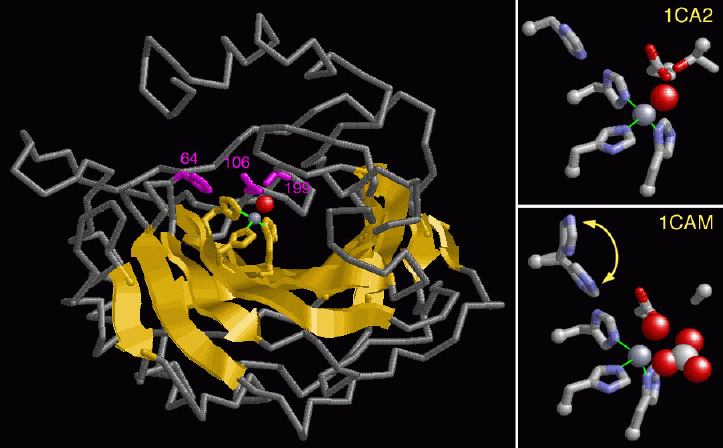
α炭酸脱水酵素はよく研究されてきており、酵素がどのようにして働くのかについての理解に結びついている。左の図はPDBエントリー 1ca2 の炭酸脱水酵素II型の構造を示している。構造の中央に黄色で示した大きなβシートがあることに注目して欲しい。活性部位は酵素の深い溝の底にあって、そこには灰色の球で示した亜鉛原子が結合している。3つのヒスチジン(histidine、94、96、119番の残基、黄色で示している)中にある窒素原子が直接亜鉛に配位している。これらアミノ酸は全てのアイソザイムで保存されている。ピンク色で示した199番のスレオニン(threonine)と106番のグルタミン酸(glutamate)は赤い球で示した水を通して間接的に相互作用する。これらの残基に加え64番のヒスチジン(同じくピンク色)が、亜鉛への水酸化物イオン(ヒドロキシルイオン、hydroxyl ion)付加を助けていることに注目して欲しい。これらの残基およびその他の残基がアイソザイムによっては異なっており、そのことで酵素の活性の違いを説明できるかもしれない。
亜鉛はこの酵素反応において重要な存在である。実際は、亜鉛イオンに結合した水が水素イオンと水酸化物イオンへと分解される。亜鉛は正電荷を帯びたイオンなので、負電荷を帯びた水酸化物イオンを安定化し、酵素が二酸化炭素に攻撃する準備ができるようにしている。右に示す2つの図は、活性部位にあるアミノ酸の側鎖と亜鉛イオンを拡大した図が上図右に示されている。右上図は赤い球で示した水酸化物イオンが亜鉛イオンに結合した PDBエントリー 1ca2 の構造を示している。亜鉛はこの結合した水酸化物イオンの二酸化炭素への転移を指示し、重炭酸イオンを作る。右下の図は、赤と白の球で示した重炭酸イオンが作られた直後で、まだ酵素に結合している中間体の構造(PDBエントリー 1cam)を示したものである。なおこの構造では、199番アミノ酸の側鎖がアラニン(alanine)にして作られていることに注意して欲しい。64番のヒスチジンは、酵素の作用サイクルの度に回転して亜鉛イオンから離れ、新たな水酸化物イオンの再補充を助けている。この残基は右下の図が示すように2つの位置があり、酵素反応中にその間で行き来する。亜鉛イオンに新たな水分子が再補充されて重炭酸イオンが解放され次第、酵素は別の二酸化炭素分子に作用する準備ができた状態となる。
"炭酸脱水酵素" のキーワードでPDBエントリーを検索した結果はこちらで参照できます。
炭酸脱水酵素についてさらに知りたい方へ
以下の参考文献もご参照ください。
- Tripp, B.C., Smith, K., and Ferry, J.G. 2001 Carbonic anhydrase: New insights for an ancient enzyme. Journal of Biological Chemistry 276 48615-48618
- Lindskog, S. 1997 Structure and Mechanism of Carbonic Anhydrase. Pharmacology and Therepeutics 74 1-20
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









