263: 아세토하이드록시산 합성효소 (Acetohydroxyacid Synthase)
생명의 진화 과정에서 생화학적/생물학적 기능은 획득되거나 상실된다. 이는 생물 전체 차원에서도 일어난다. 예를 들어 자연선택의 결과, 나비는 잎처럼 변함으로써 포식자를 상대로 완전히 위장할 수 있다. 한편, 동굴에 서식하는 동물은 서식하는 어두운 환경에서 진화와 자연선택 과정에서 점차 색각과 시각 능력을 잃어간다. 마찬가지로 진화는 분자 수준에서도 일어난다. 식물에는 환경에 있는 단순한 영양소에서 모든 아미노산을 처음부터 만드는 데 필요한 분자 기구가 갖추어져 있다. 그런데 동물은 진화 과정에서 이 능력을 잃어버리고 말았다. 우리가 먹는 동식물에는 안정적인 양의 아미노산이 포함되어 있기 때문에 세포가 모든 아미노산을 만들 필요는 없는 것이다. 대신 세포는 이들 아미노산을 만드는 데 필요한 에너지를 생존에 필요한 다른 기능으로 돌릴 수 있다. 아득한 옛날 그 어디쯤에서 우리들의 세포는 9종류의 아미노산을 만드는 능력을 잃었다. 그리고 오늘날, 이들 아미노산은 우리 식사에 필요한 필수 아미노산(essential amino acids)으로 분류되고 있다.
아미노산을 만들다
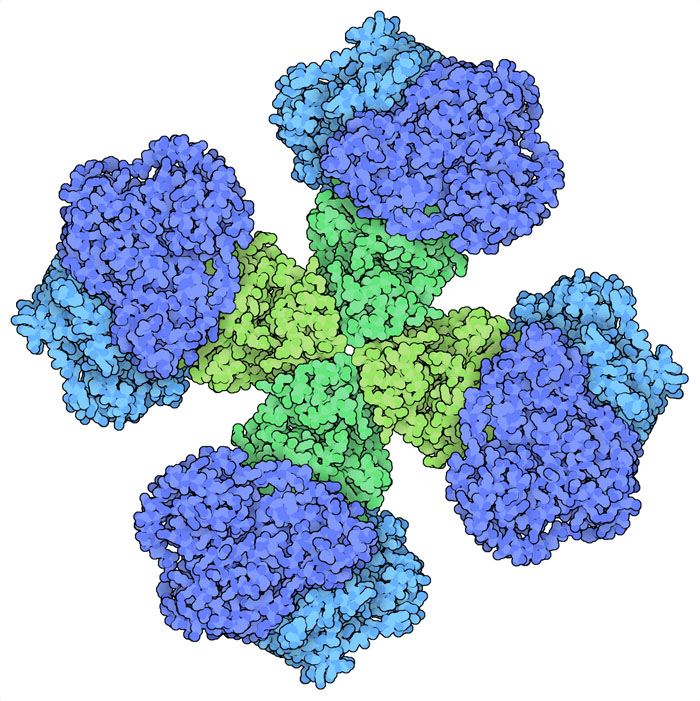
류신(leucine), 발린(valine), 아이소류신(isoleucine)은 우리 식사에 ‘필수’적인 3종류의 아미노산이다. 이들은 모두 탄소와 수소로만 구성되어 짧게 갈라진 곁사슬을 갖고 있으며, 합쳐서 가지사슬 아미노산(Branched Chain Amino Acid, BCAA)으로 불린다. 식물, 세균, 균류는 해당계(glycolysis)로 만들어진 피루브산(pyruvate)을 이용해 이들 아미노산을 만들 수 있다. 효소인 아세토하이드록시산 합성효소(acetohydroxyacid synthase, AHAS, 여기에 나타낸 것은 PDB 엔트리 6vz8의 구조)는 합성에 있어서의 첫 단계를 실시한다. 발린을 만들 때 이 효소는 2분자인 피루브산을 사용한다. 한쪽 분자에서 이산화탄소를 뽑아내고 남은 부분을 다른 쪽 분자에 붙여 아미노산의 크기를 갖는 전구체를 만든다. 다음으로 다른 효소 3종류가 분자 내에 있는 원자를 교체하고 ‘아미노’기를 부가해 아미노산이 생긴다. 마찬가지로 류신을 만들 때도 여러 종의 효소가 필요하다. 아이소류신의 경우 두 번째 피루브산 대신 조금 큰 다른 분자를 사용해 합성이 시작된다.
합성 경로
우리는 이들 생합성 효소가 경로(pathway)에 줄지어 있다는 개념으로 파악하는 경우가 많으며, 이 경로 상에서 분자는 차례차례 효소를 만나 단계적으로 수식되어 간다. 종종 이 경로 상에는 ‘일단 통과하면 되돌릴 수 없는’(committed) 단계를 담당하는 열쇠가 되는 효소가 있다. 예를 들어 AHAS는 발린과 류신의 합성에 있어서 첫 단계를 수행하는데, 이 단계를 거쳐 2개의 피루브산 분자가 연결되어 하나가 되면 이들 아미노산을 생산하는 데만 사용되게 된다. 되돌릴 수 없는 단계는 후술하듯이 생합성 과정을 제어하는 장소로 되는 경우도 많다. 또한 이 장소는 저해제에 의해 합성 경로를 방해 받기 쉬운 취약한 장소가 되기도 한다. 널리 사용되고 있는 시판의 제초제 중에는 AHAS를 표적으로 하는 것이 많이 존재한다. 이는 매력적인 표적이라고 할 수 있다. 왜냐하면 이들 제초제는 필수적인 기능을 저해하므로 매우 효과적이지만 우리는 AHAS가 없기 때문에 사용해도 안전하기 때문이다.
피드백을 얻다
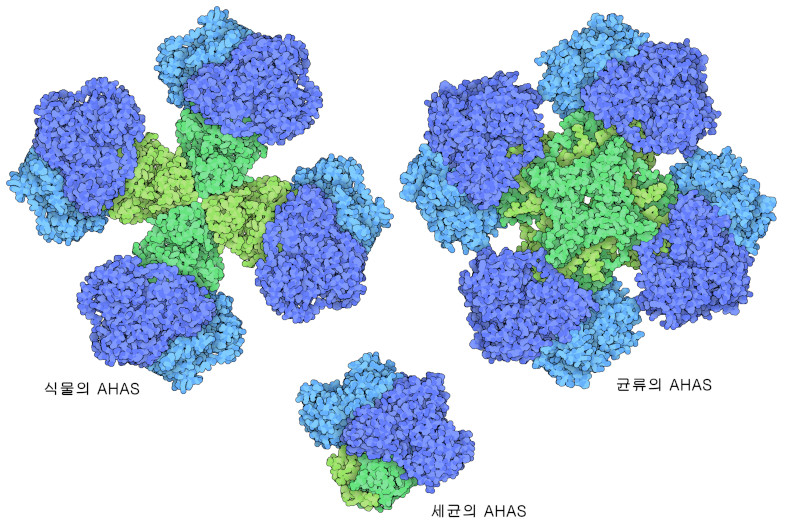
AHAS는 아미노산 합성에 있어 중요한 단계를 담당하고 있으므로 효소의 활성을 제어하는 좋은 후보가 된다. AHAS 효소는 보통 2개의 서브유닛을 가진다. 하나는 반응을 수행하는 촉매 서브유닛(catalytic subunit), 다른 하나는 작용을 제어하는 조절 서브유닛(regulatory subunit)이다. 발린이 풍부하면 조절 서브유닛에 결합해 촉매 서브유닛을 활성이 낮은 형태로 바꾼다. 그 결과, 가지사슬 아미노산의 생산이 느려진다. 하지만 발린 농도가 낮으면 조절 서브유닛에 결합하는 분자의 양이 부족해져 복합체는 완전히 활성형으로 돌아간다. 다른 생물을 살펴보면 촉매 서브유닛은 매우 비슷하지만 조절 서브유닛은 다양하다는 것을 알 수 있다. 여기에는 3가지 사례를 나타낸다. 식물의 AHAS(PDB 엔트리 6vz8)에는 4개의 큰 조절 서브유닛이 있는 반면 균류에서 유래한 AHAS(PDB 엔트리 6u9d)에는 크기가 식물의 절반인 조절 서브유닛이 8개 있다. 또한 세균의 AHAS(PDB 엔트리 6lpi)에 있는 조절 서브유닛은 2개이고 복합체 전체로는 더 작다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
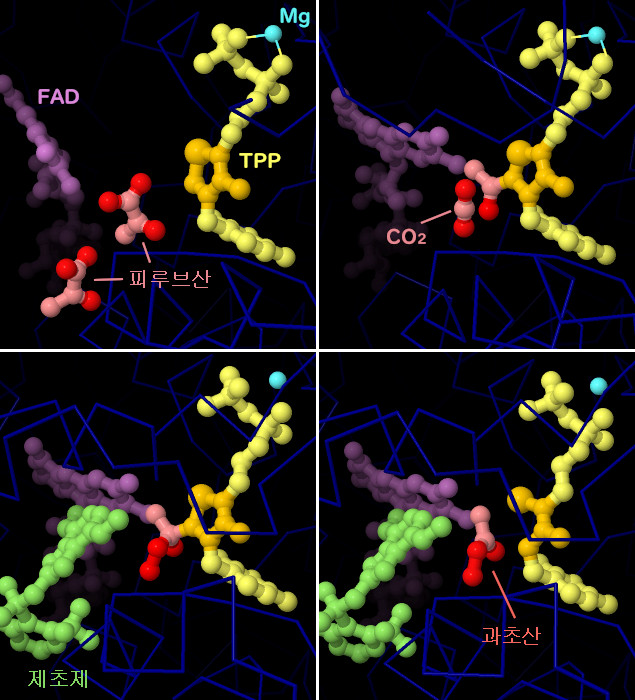
효모에서 유래한 AHAS의 결정구조로부터 촉매반응의 각 단계나 제초제가 어떻게 반응을 저해하는지 밝혀졌다. 활성 부위는 반응을 돕는 데 몇 가지 보조 인자를 사용한다. 티아민 보조 인자(thiamine cofactor, TPP, 노란색으로 나타낸 부분, 반응성 링은 주황색으로 나타냄)는 이산화탄소를 제거하는 중심적인 반응을 수행한다. 마그네슘 이온(Mg, 청록색)은 보조 인자를 적절한 위치에 배치시킨다. AHAS는 FAD(자홍색)에도 결합하지만 활성형 효소에서 FAD는 환원 상태로 되어 있어야 한다. 또한 몇 개의 산소 분자(여기에는 나타내지 않음)에도 결합하지만 기능은 알려져 있지 않다. PDB 엔트리 6bd9에는 활성 부위에 들어간 2분자인 피루브산(빨간색과 분홍색)이 포함되고 PDB 엔트리 6bd3에서는 이 한쪽이 티아민 보조 인자에 부가되어 이산화탄소가 제거된 후의 상태를 포착했다. PDB 엔트리 5wkc에는 활성 부위 입구를 방해하고 있는 제초제 분자(페녹스술람, penoxsulam, 녹색 부분)가 포함되어 있다. 이는 또 다른 문제도 야기한다. 이 구조에 있어서 부가된 기질 분자는 반응성이 풍부한 산화된 분자로 변환되어 있다. 이 PDB 엔트리의 다른 서브유닛에서는 반응성 분자(에탄퍼옥소산, 과초산, ethaneperoxoic acid)가 방출되어 파괴된 링을 가진 손상된 티아민 보조 인자가 남아 있다. 또한 에탄퍼옥소산은 FAD도 산화해 효소의 작용을 더욱 저해할 가능성이 있다. 이러한 구조를 보다 자세하게 보기 위해 그림 아래의 버튼을 클릭하여 인터랙티브 조작이 가능한 이미지로 전환해 보기 바란다.
이해를 높이기 위한 토픽
- AHAS의 작용을 저해하는 제초제에는 여러 종류가 있으며, 모두 기질이 활성 부위로 들어가는 것을 저해합니다. 그러나 각각의 구조나 결합 방법은 조금씩 다릅니다. AHAS를 키워드로 사용하여 PDBj 사이트에서 검색하고 그 구조들을 살펴보십시오.
- PDB 아카이브에 있는 다양한 AHAS의 구조를 조사하면 여러 가지 모양이나 크기의 복합체가 발견되는 것에 주의해 주십시오. 예를 들어 그러한 구조의 대부분은 촉매 서브유닛의 2량체밖에 포함되지 않지만 제초제가 결합했을 때 모여서 4량체를 형성하는 것이 자주 있습니다. 그렇기 때문에 이 기사에서 나타낸 특징적인 십자형 집합체는 볼 수 없을 것입니다.
참고문헌
- 6vz8、6u9d 2020 Structures of fungal and plant acetohydroxyacid synthases. Nature 586 317-321
- 6lpi 2020 Molecular architecture of the acetohydroxyacid synthase holoenzyme. Biochem J 477 2439-2449
- 5wkc 2018 Structural insights into the mechanism of inhibition of AHAS by herbicides. Proc Natl Acad Sci U S A 115 E1945-E1954
- 6bd9、6bd3 2017 High resolution crystal structures of the acetohydroxyacid synthase-pyruvate complex provide new insights into its catalytic mechanism. ChemistrySelect DOI:10.1002/slct.201702128
- 2016 Acetohydroxyacid synthases: evolution, structure, and function. Appl Microbiol Biotechnol 100 8633-8649
- 2010 An evolutionary perspective on amino acids. Nature Education 3(9) 29
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









