250: カプサイシン受容体TRPV1(Capsaicin Receptor TRPV1)
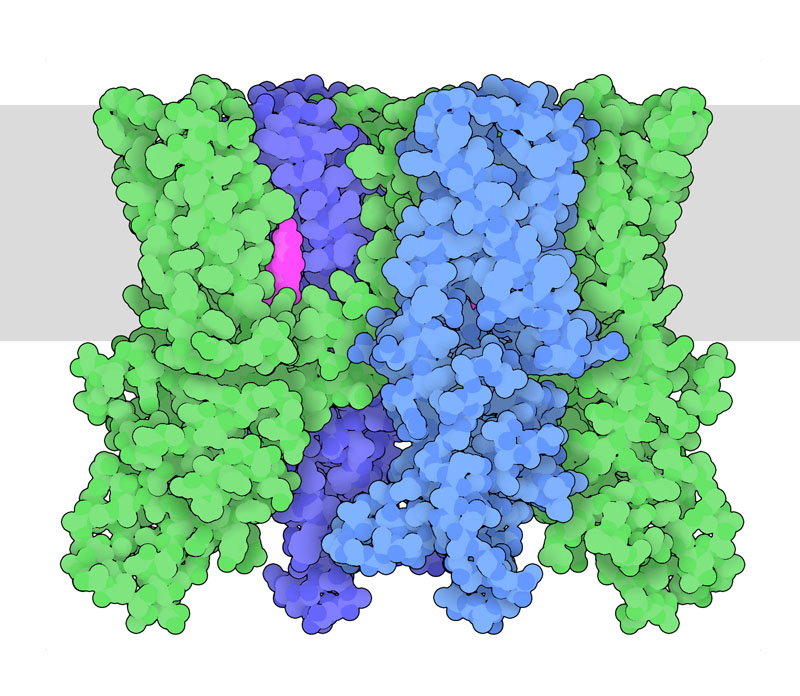
なぜコショウの中には辛い味のするものがあるのか不思議に思ったことはないだろうか? ピリッとした味がある植物には、チリペッパーに含まれるカプサイシン(capsaicin)や黒コショウに含まれるピペリン(piperine)のように植物を守る有害物質が含まれている。TRPV1はイオンチャネルの一種だが、驚くべきことに、カプサイシンのような分子によって活性化されたときにも、温度が非常に高くなったときにも開く。だから、TRPV1は熱の検知にも、辛い食べ物の味覚にも関わっていて、似た感覚を起こしているのである。
ホットなもの
TRPV1 は一過性受容体電位型イオンチャンネル(transient receptor potential ion channel、TRPイオンチャネル)と呼ばれる大きなグループ(superfamily)に属するタンパク質の一つで、低温、メントール(menthol)のような冷感物質、酸、生物活性脂質などのさまざまな物理的・化学的な刺激に反応する。TRPチャネルはどれも全体的に似た構造をしていて、同じサブユニットが4つ集まってできたチャネルが特定の刺激に反応して開閉し、膜を越えて陽イオンを流す。なお、TRPV1 の「V」はタンパク質に結合するカプサイシンのようなバニロイド(vanilloid)分子を指している。
クライオ電子顕微鏡とナノディスク
PDBエントリー5is0は、カプサイシンに似た分子がTRPV1に結合している様子を示している。その分子はサブユニット間にあって、チャネルの穴を通るイオンの流れを制御するゲートの一つに近い窪みに結合している。この構造は、チャネルを精製して脂質のナノディスク(nanodisc)に入れ、クライオ電子顕微鏡を使って調べ決定された。EMデータバンク(EMD-8119)でクライオ電子顕微鏡マップをみると、脂質でできたナノディスクが、タンパク質の膜にかかる領域をとり囲んでいることが分かるだろう。
カルシウムを集める
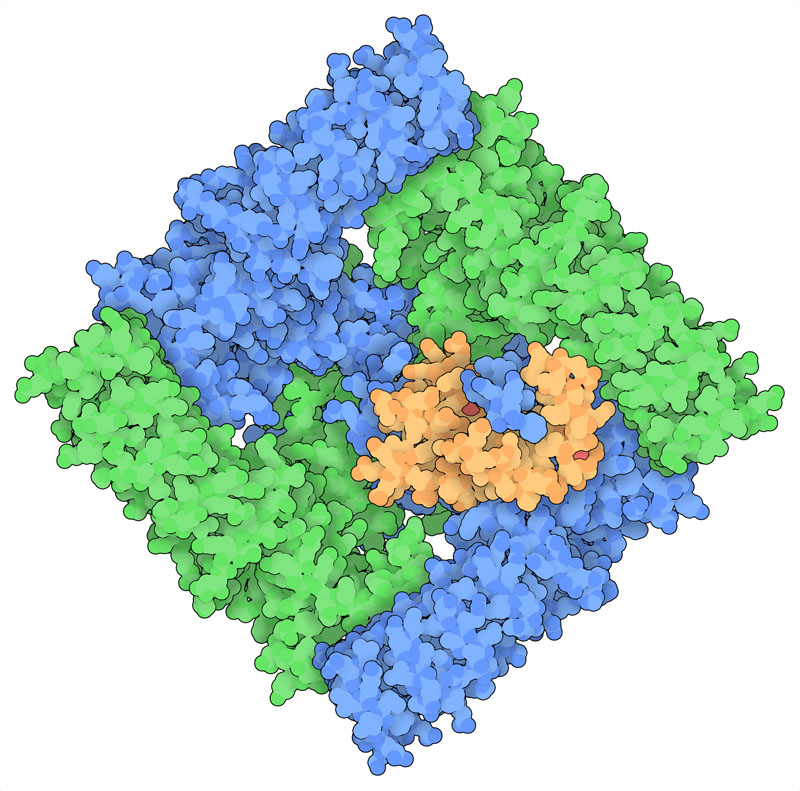
TRPV5チャネルはTRPV1とは少し異なる役割をしている。このチャネルは腎臓に見られ、カルシウムを再吸収して排出しないようにするのに役立っている。TRPV1とは異なり、TRPV5は通常開いた状態になっていて、カルシウムイオンが尿から腎臓細胞へ戻るようにしている。しかし、カルシウムの量が過剰になると、カルシウムの量を検知するカルモジュリン(calmodulin)がTRPV5に集められ、細胞内にカルシウムが流れ込むのを止める。その様子がPDBエントリー6dmwで見ることができる。
構造をみる
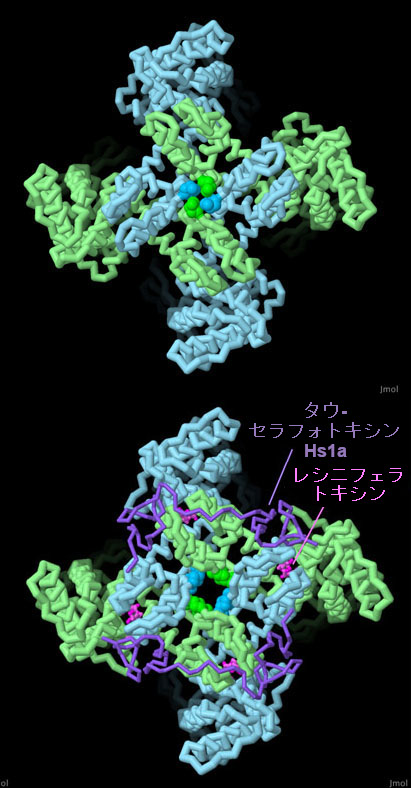
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
クライオ電子顕微鏡を使ってTRPチャネルのさまざまな状態をとらえることができるようになった。PDBエントリー5irzは閉じた状態のTRPV1チャネルで、アミノ酸でできたいくつかの環がイオンの通る穴をふさぐ構造をつくっている。一方、PDBエントリー5irxは、2つの毒素を結合させてチャネルが開いた状態を維持している構造である。アミノ酸の位置がずれ、イオンの通る経路が開いている。画像の下のボタンをクリックして対話的操作のできる画像に切り替え、これらの構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
- PDBアーカイブには数多くのTRPチャネルが登録されています。TRPチャネルのキーワードを使ってPDBjで検索し、それらを見てみてください。
- 他にも多くのイオンチャネルがリング状のサブユニットやドメインでできています。TRPチャネルの構造と、ピエゾ1機械受容チャネル、カリウムチャネル、機械受容チャネルの構造を比較してみてください。
参考文献
- 2002 Structural insights into the gating mechanisms of TRPV channels. Cell Calcium 87 102168
- 2020 High-resolution structures of transient receptor potential vanilloid channels: Unveiling a functionally diverse group of ion channels. Prot. Sci. 29 1569-1580
- 6dmw 2018 Structural insights on TRPV5 gating by endogenous modulators. Nat Commun 9 4198-4198
- 5is0、5irx、5irz 2016 TRPV1 structures in nanodiscs reveal mechanisms of ligand and lipid action. Nature 534 347-351
- 2007 TRP channels. Annu Rev Biochem 76 387-417
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









