44: カルモジュリン(Calmodulin)
構造と信号
カルシウム(Calcium)は体内で最も豊富に見られる無機成分で、その次に多いのが亜リン酸(phosphorous)である。ただこれは恐らく驚くようなことではないだろう、というのも私たちの骨は約2kgのカルシウムと亜リン酸によって強化され支えられているのだから。また私たちは少量のカルシウムも、カルシウムイオンという形で用い、それによってより活動的な役務も遂行している。カルシウムイオンは、細胞の信号伝達において不可欠な役割を果たしており、筋肉収縮(muscle contraction)、神経伝達(nerve signaling)、受精(fertilization)、細胞分裂(cell division)などの過程制御を助けている。カルシウムポンプと数種のカルシウム結合タンパク質の働きを通して、細胞は内部のカルシウム濃度を血液中のカルシウム濃度に比べ千〜一万倍低い状態に保っている。そして、カルシウムが細胞内に流れ込んだ時、カルシウムはカルシウム検知タンパク質と相互作用できるようになり、これが筋肉の収縮、膵臓(pancrea)からのインスリン(insulin)放出、卵受精後の更なる精細胞侵入阻止などの、別の生物学的な結果を引き起こすきっかけとなる。
カルシウムの検知
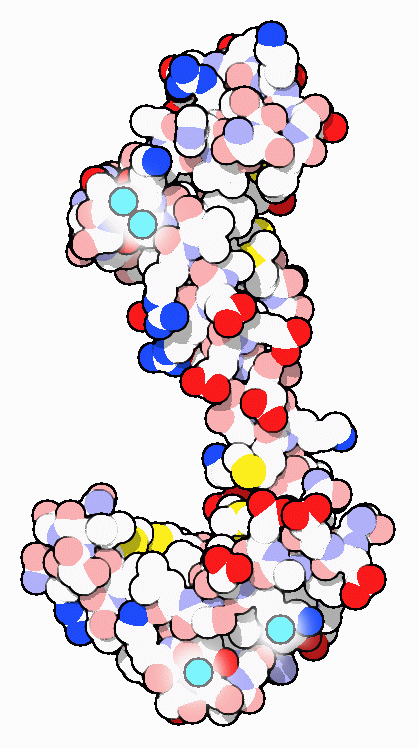
名前が示すように、カルモジュリン(カルモジュリン)はカルシウムによって調整されるタンパク質(CALcium MODULated proteIN)で、高等生物細胞の細胞質で豊富に見られ、進化を通じて高度に保存されてきた。カルシウム濃度を検知し、様々なカルシウム感受性酵素、イオンチャンネルなどのタンパク質へ信号を伝える仲介タンパク質として働いている。カルモジュリンは2つの球状ドメインが柔軟な結合部分でつながれ、ダンベルのような形になった小さなタンパク質である。それぞれの端にはカルシウムイオンが2個ずつ結合する。ここに示すPDBエントリー 3cln は4つの結合部位が全てカルシウムで満たされ、ドメイン結合部分は長いαらせんを形成して2つのカルシウム結合ドメインを引き離している。
カルモジュリンのそっくりさん
様々な種類のタンパク質が細胞内外のカルシウム濃度の影響を受ける。1960年代の終わり、カルモジュリンが発見される前に、トロポニンC(troponin C、例:PDBエントリー 1tcf)が最初のカルシウム感受性タンパク質として発見された。トロポニンCはカルシウム濃度の上昇を検知し、筋肉収縮を引き起こす。トロポニンCとカルモジュリンの構造は非常によく似ていて、主な違いと言えば2つの球状カルシウム結合ドメインをつなぐ結合部分の長さが違うことぐらいである。後に詳しく説明する、タンパク質のカルシウム結合領域はほとんど同じである。この部分構造(motif、モチーフ)は他のカルシウム感受性タンパク質で何十個も見つかっている。
全ての機能を持つ分子
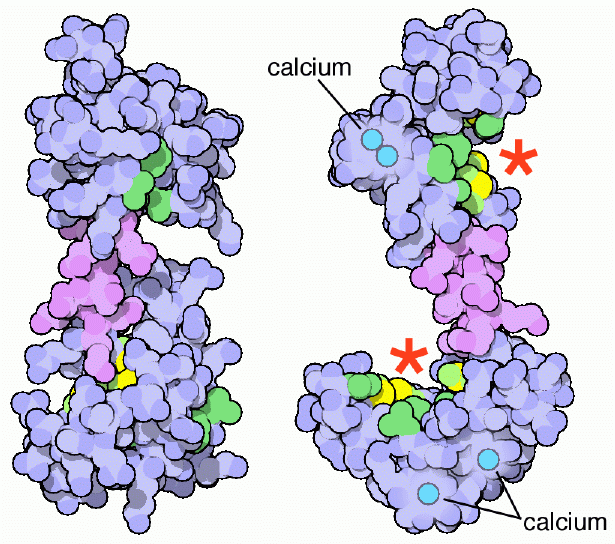
カルモジュリンが標的とするタンパク質には様々な形、大きさ、配列のものがあり、いろいろな機能のものが含まれる。例えば、カルシウムに結合したカルモジュリンは、グリコーゲンの分解を調節している調節酵素ホスホリラーゼキナーゼ(phosphorylase kinase、加リン酸分解酵素 リン酸化酵素)の重要なサブユニットを形成する。また、細胞信号伝達、イオン輸送、細胞死に関して重要な役割を果たす別のキナーゼ、ホスファターゼにも結合して活性化させる。カルモジュリンと標的タンパク質との接触に関して共通するテーマの一つは、疎水性相互作用(非極性相互作用、non-polar interaction)特に、カルモジュリンが珍しく豊富に持っているメチオニン(methionine)を使っているということである。カルシウムが結合することにより、カルモジュリンの非極性表面は外に露出し、そこに標的タンパク質の非極性領域が結合する。上図に示すカルモジュリンは、左側(PDBエントリー 1cfd)がカルシウムの結合していない状態の、右側(PDBエントリー 1cll)がカルシウムの結合した状態のものである。重要な非極性領域にある炭素原子は緑色で、多数存在するメチオニン中の硫黄原子は黄色で示している。カルシウムが結合したとき、これら非極性アミノ酸がどのようにして2つのきちんとした溝(赤い星印で示した部分)を形成し、標的タンパク質をつかむのを待っているのかに注目して欲しい。この非極性の溝は汎用的な形をしているため、カルモジュリンは万能の調節タンパク質として働く。そのため標的タンパク質は特別なアミノ酸配列や結合モチーフ構造を持たなくて済むのである。
カルモジュリンの柔軟性
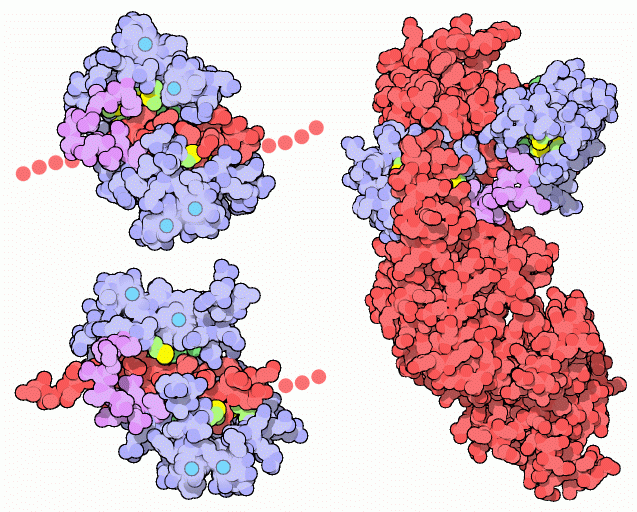
NMRの研究により、2つのカルシウム結合球状ドメインをつなぐ結合部分は、標的タンパク質に結合していない時でも柔軟であることが明確に示されている。ところが、柔軟性を能力いっぱいまで示すのはカルモジュリンが標的タンパク質との相互作用している時である。通常カルモジュリンは、2つの球状ドメインが互いに標的タンパク質の反対側つかんでそれらを包みこむ。上図左に示す2つの構造は、カルモジュリンが2つの異なる標的酵素に結合した様子を示したもので、上はカルモジュリン依存性のタンパク質リン酸化酵素II-α(calmodulin-dependent protein kinase II-alpha、PDBエントリー 1cm1)と、下はミオシン軽鎖リン酸化酵素(myosin light chain kinase、PDBエントリー 2bbm)と結合した状態を示している。どちらも、標的タンパク質鎖(赤)の小さな断片しか結晶構造中には含まれていない。この柔軟な結合部分(紫色の部分)が、どのようにして2つの標的のわずかな形の違いに合わせられるようにしているのかに注目して欲しい。また別の結合様式が炭疽菌(anthrax bacteria)の浮腫因子(edema factor)で見られる(上図右、PDBエントリー 1k93)。赤で示す部分が毒素である。カルモジュリンが毒素に結合すると、毒素の構造が変化してアデニル酸環化酵素(adenylyl cyclase)活性が活性化される。これにより宿主細胞の貯蔵されたエネルギーが枯渇する。細菌はカルモジュリンを持っていないので、炭疽菌は宿主が豊富に持つカルモジュリンを搾取し、それによって毒性を始動させ宿主の細胞機械を乗っ取る目的を果たすよう巧妙に進化してきた。
構造をみる
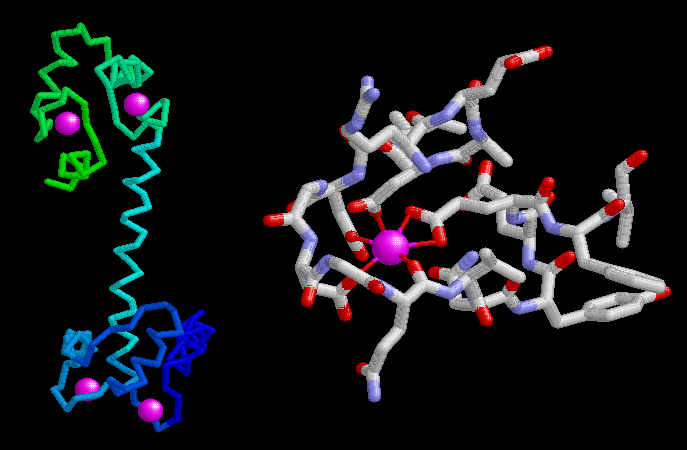
カルモジュリンには、上図左(PDBエントリー 1cll)に主鎖表現で示すようにほぼ同じで高い類似性を持つカルシウム結合部位が4つある。ここでカルシウムイオンは赤紫色で示している。カルシウム結合モチーフは2つのαらせんが側面をかためている特徴的な環状構造でできている。また上図右に示すように、正電荷を持ったカルシウムイオンは環状領域の中で3つのアスパラギン酸と1つのグルタミン酸による負電荷を持った側鎖に加え、タンパク質鎖の主鎖にある酸素原子によっても囲まれている。
"カルモジュリン" のキーワードでPDBエントリーを検索した結果はこちらで参照できる。また、遺伝的視点からみたカルモジュリンに関する記事が欧州バイオインフォマティクス研究所(EBI)で提供されている「今月のタンパク質」に掲載されているので合わせて参照のこと。
更に知りたい方へ
以下の参考文献・サイトもご参照ください。
- 2003 Novel aspects of calmodulin target recognition and activation. Eur. J. Biochem. 270 404-414
- CaBPデータライブラリ(
http://structbio.vanderbilt.edu/cabp_database) - 2002 A molecular full nelson. Nature 415 373-374
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









