246: SARS 코로나바이러스 2형 스파이크 (SARS-CoV-2 Spike)
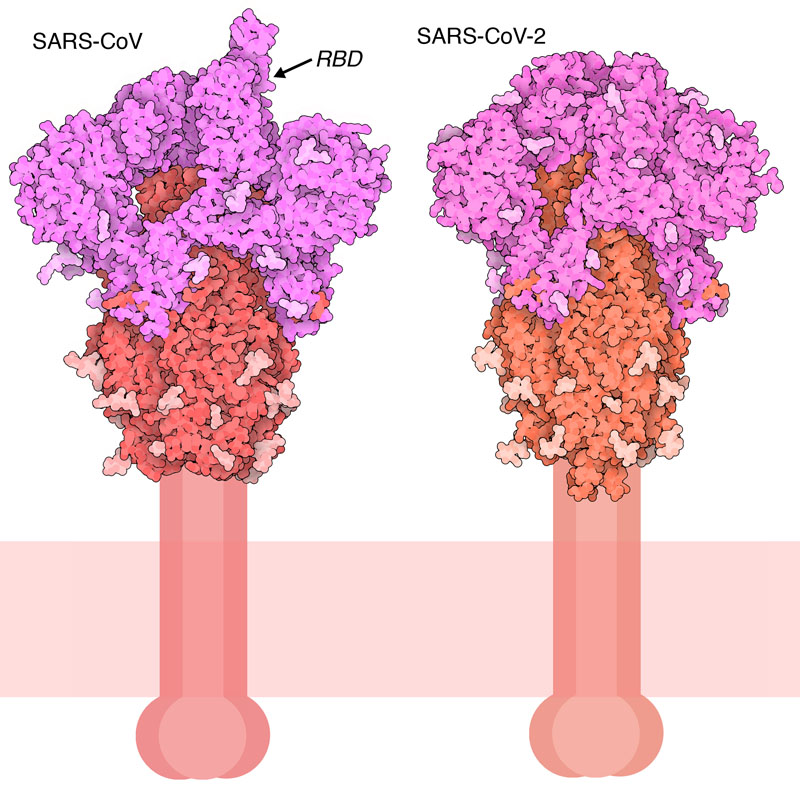
과거 유행했던 SARS 코로나바이러스(SARS-CoV)에 관한 오랜 연구를 바탕으로 현재 유행하고 있는 신종 코로나바이러스(SARS-CoV-2)에 대한 대책이 시급히 추진되고 있다. 이 바이러스의 스파이크 단백질(spike protein)은 바이러스에 대항하는 면역의 근원이 되는 항체의 주된 표적이 되기 때문에 감염증 대책에서 우선 첫째로 연구 대상이 되는 단백질이다. 코로나바이러스는 표면이 이 스파이크로 덮여 있기 때문에 전자현미경으로 본 외관은 독특한 왕관 모양이다. 스파이크는 수용체와 결합하여 세포막과 융합해 바이러스 게놈을 세포 안으로 방출함으로써 일련의 감염 과정이 시작된다. 다른 외피를 가진 바이러스도 상당수가 이와 비슷한 스파이크 모양의 단백질을 사용해 세포에 감염된다. 예를 들어 인플루엔자 바이러스인 적혈구 응집소 (influenza hemagglutinin) , 그리고 에이즈 바이러스-1(HIV-1)이나 에볼라 바이러스(Ebolavirus)의 외피 당단백질을 들 수 있다.
적당한 사이즈로 커트
스파이크 단백질은 3개의 동일한 사슬로 구성되고, 이들이 모여 바이러스 내부에 있는 작은 도메인, 막으로 이어지는 부분, 그리고 바이러스 밖으로 돌출된 큰 외부 도메인을 만들고 있다. 게다가 스파이크는 당단백질이고 외부 도메인은 바이러스를 면역계로부터 숨기는 데 도움이 되는 당사슬로 덮여 있다. SARS 코로나바이러스와 신종 코로나바이러스(SARS-CoV-2)에서 얻은 스파이크 단백질의 외부 도메인만의 구조(6crz, 6vxx)를 여기에 나타낸다. 보다시피 양자가 매우 흡사하다. 각 사슬은 먼저 연결된 1개의 사슬로 합성되고 이후 세포가 갖는 프로테아제에 의해 절단되어 2개의 기능 단위로 나뉜다. 바깥쪽 S1 영역(자홍색)은 세포 수용체와 결합하고 S2 영역(빨간색)은 바이러스와 세포의 융합을 지시한다. 두 구조 모두 당사슬에 대해서는 스파이크 단백질을 덮는 부분밖에 포함되지 않는다. 왜냐하면 당은 유연성이 높고 관찰이 어렵기 때문이다.
유연하다는 특징
최근 규명된 구조에서 SARS-CoV와 SARS-CoV-2의 스파이크는 모두 매우 유연한 것으로 나타났다. 이들 구조를 보면 수용체 결합 도메인의 배치가 다르다. 도메인이 1개만 위에 나와 있는 경우는 흔하지만 모두가 움푹 패여 있거나 여러 도메인이 밖으로 나와 있기도 하다. 밖으로 나온 배치는 수용체와 결합하는 데 필요하므로 이 유연함은 바이러스에게 매우 유리하다. 최근 변이형 SARS는 수용체 결합 도메인의 유연성이 특히 높아 악성이 많고 더 널리 퍼져 있으며, 일반적인 감기를 일으키는 코로나바이러스는 유연성이 낮기 때문에 위험도는 그나마 낫다는 가설이 세워졌다.
수용체와의 결합
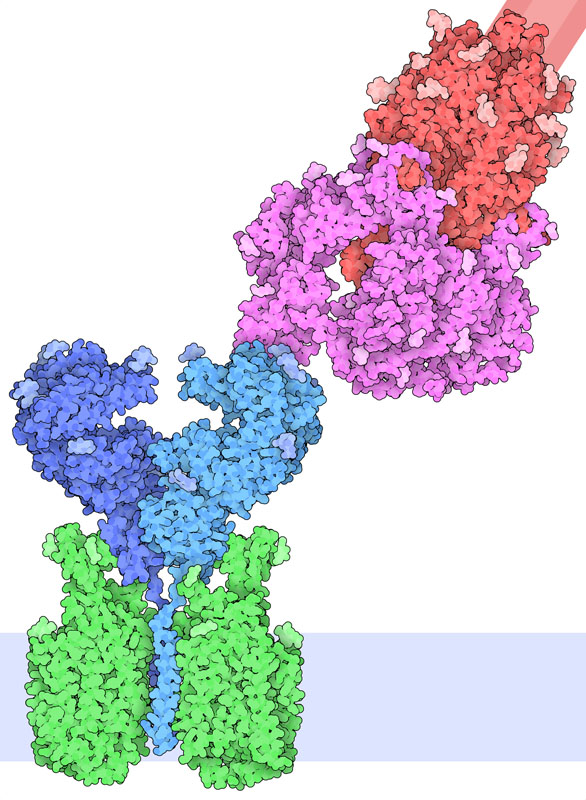
스파이크 단백질은 세포 표면에 있는 ACE2(안지오텐신 변환 효소2, angiotensin-converting enzyme2)에 결합한다. ACE2는 혈압 조절과 관련된 펩타이드 호르몬 중 하나인 안지오텐신을 활성화하는 효소다. ACE2는 폐, 심장, 신장, 장의 세포에서 볼 수 있으며 이들 세포는 바이러스에 의한 감염 대상이다. PDB 엔트리 6m17의 구조를 통해 ACE2에 SARS-CoV-2 스파이크 단백질의 수용체 결합 도메인이 결합된 복합체의 구조가 밝혀졌다. 복합체 중에서 ACE2는 아미노산 수송체 B0AT1에도 결합되어 있다. 여기에 나타낸 그림은 이 복합체의 구조에 PDB 엔트리 6vsb에서 얻어진 스파이크 단백질의 구조를 중첩하여 그린 것이다.
구조 보기
인터랙티브 조작이 가능한 페이지로 전환하려면 그림 아래의 버튼을 클릭하십시오. 읽기가 시작되지 않을 때는 그림을 클릭하십시오.
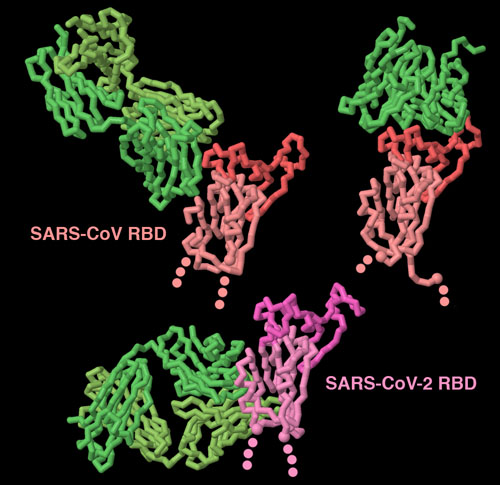
우리가 코로나바이러스에 감염되면 우리 면역계는 이에 대항한다. 스파이크는 바이러스 표면에 노출되어 있기 때문에 이 대항 조치의 주된 대상이 된다. 이들 3가지 구조(PDB 엔트리 3bgf, 2ghw, 6w41)는 항체(녹색)가 다양한 방법으로 스파이크 단백질을 인식할 수 있음을 나타낸다. 이중 2개는 도메인의 수용체 결합 부위(짙은 색으로 나타낸 부분)를 저해하고 있다. 그리고 또 1개의 항체는 도메인 기부에 숨은 부분을 대상으로 하고 있다. 이 부분은 항체가 결합했을 때만 밖으로 노출된다. 이러한 구조를 보다 자세하게 보기 위해 그림 아래의 버튼을 클릭하여 인터랙티브 조작이 가능한 이미지로 전환해 보기 바란다.
이해를 높이기 위한 토픽
- 신종 코로나바이러스(SARS-CoV-2) 및 신종 코로나바이러스에 의한 감염증(COVID-19)에 대하여 보다 자세한 정보가 메인의 RCSB PDB 사이트, RCSB PDB의 교육 사이트 PDB-101 및 PDBj에 있습니다.
참고문헌
- 6vxx 2020 Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell 181 281-292
- 6w41 2020 A highly conserved cryptic epitope in the receptor-binding domains of SARS-CoV-2 and SARS-CoV. Science 10.1126/science.abb7269
- 6vsb 2020 Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 367 1260-1263
- 6m17 2020 Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science 367 1444-1448
- 6crz 2018 Stabilized coronavirus spikes are resistant to conformational changes induced by receptor recognition or proteolysis. Sci Rep 8 15701-15701
- 3bgf 2009 Structural insights into immune recognition of the severe acute respiratory syndrome coronavirus S protein receptor binding domain. J Mol Biol 388 815-823
- 2ghw 2006 Structural basis of neutralization by a human anti-severe acute respiratory syndrome spike protein antibody, 80R. J Biol Chem 281 34610-34616
 의 생체 고분자 학습 포털 사이트
의 생체 고분자 학습 포털 사이트 









