133: 一酸化窒素合成酵素(Nitric Oxide Synthase)
ニトログリセリン(nitroglycerin)は強力な爆発物で、熱や圧力を受けると爆発する。ところがこの同じ分子が、心臓発作を経験している人の命を救うことができる。少量のニトログリセリンを摂取するとゆっくり分解され、一酸化窒素(nitric oxide、NO)が放出される。これは血管を取り囲む筋肉細胞に拡散して血管の拡張を促す。治療に使えるというニトログリセリンの性質はこのようにして一世紀以上に渡って利用されてきたが、一酸化窒素がこの働きを行う仕組みが明らかになったのはごく最近になってからである。
一酸化窒素は問題なし(NO Problem)
一酸化窒素は無色の気体で、窒素原子と酸素原子とでできている。一酸化窒素は身体内において信号伝達(signaling)と攻撃(attack)という2つの場面で用いられる。細胞では低濃度ではあるが継続的に一酸化窒素が作られており、筋肉細胞の収縮や神経細胞の成長といった機能を制御する信号を伝える役目を果たしている。一酸化窒素はとりわけ信号伝達に効果的である。それは分子が小さいため急速に拡散するが、素早く反応してすぐ不活性化するので効果のおよぶ範囲は比較的限られるからである。この反応性は一酸化窒素が持つ他の主な機能でも用いられている。免疫機構では病原菌を殺すため細胞を破裂させる際に一酸化窒素が作られている。
一酸化窒素合成酵素(NOS)
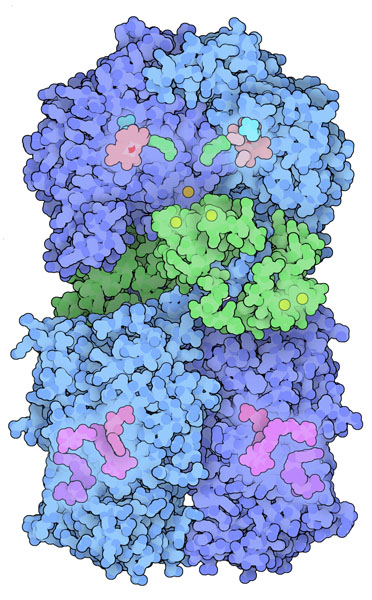
動物細胞はこのそれぞれの機能に使う一酸化窒素を産生するため、3種類の似た一酸化窒素合成酵素(nitric oxide synthase、NOS)を作る。神経性NOS(neuronal NOS、右上図)と内皮性NOS(endothelial NOS)は信号伝達に使う一酸化窒素を低濃度で産生する。一方、誘導性NOS(inducible NOS)は病原菌に対抗するため大きな毒性の破裂を引き起こす。いずれも多数の機能部位を持つ複合体酵素であり、扱いやすい断片に分けて構造が決定されてきた。図の上部に示す部分は、アミノ酸の一つアルギニン(arginine)に酸素を付加して一酸化窒素を作り出す。なおこの反応は、ヘム(heme)グループの助けを借りて行われている。この部分が最初に結晶構造の研究がなされた部位で、まずは誘導性NOS(PDBエントリー 1nod)の構造が、続いて神経性一酸化窒素合成酵素(PDBエントリー 1om4)の構造が解かれた。図の下部に示した構造(PDBエントリー 1tll)は上部へ電子を供給する。2つの部位をつなぐ短い断片はカルモジュリン(緑色の部分、PDBエントリー 2o60)で、電子の流れの制御を助ける。
一酸化窒素(NO)というメッセージを伝える
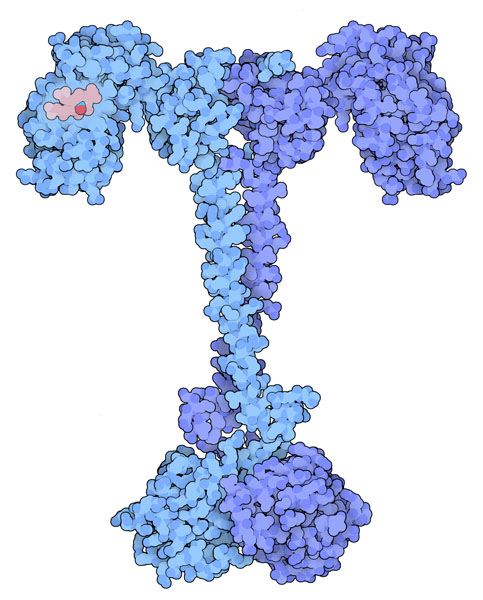
一酸化窒素によって運搬される情報は、可溶性グアニル酸環化酵素(soluble guanylate cyclase、グアニル酸シクラーゼ)によって受けとられる。この酵素は細胞内において一酸化窒素に反応して一連の系を開始させる酵素複合体である。一酸化窒素分子がこの酵素に結合すると、酵素は活性状態となりGTPを環状GMP(cyclic GMP)へと変換する。この分子が次に二次信号伝達物質として作用し、リン酸化酵素(kinase)を活性化する。この酵素が次に生理学的機能を果たすのに必要な分子全てを動員する。NOSと同様に、可溶性グアニル酸環化酵素も複数のドメインから成る複合体で、部分ごとに分けて結晶構造の研究が行われた。この酵素は、一酸化窒素結合ドメイン(NO-binding domain、PDBエントリー 2o0c、右図上部)、環化酵素(cyclase enzyme、PDBエントリー 3et6、右図下部)、および前2者をつなぐその他のドメイン群(PDBエントリー 3hls、2p04)で構成されている。
構造をみる
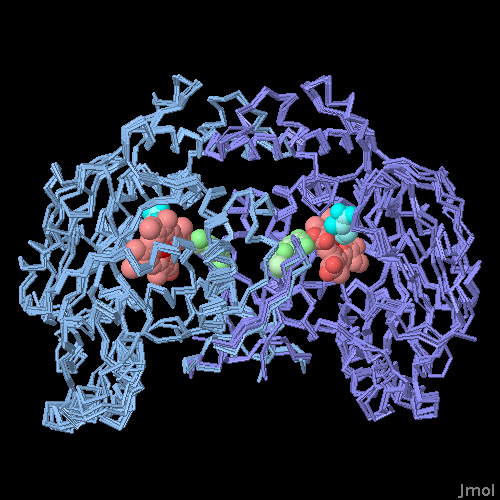
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
3つの型のNOSは互いに似ているが、その小さな違いがある型を阻害し他の型は阻害しない薬剤を作るのに利用されている。これは非常に役に立つことになるだろう。例えば、誘導性NOSはパーキンソン病(Parkinson's disease)、アルツハイマー病(Alzheimer's disease)、多発性硬化症(multiple sclerosis、MS)においてある役割を担っているため、ある型だけを阻害し、他の型のNOSを阻害しない薬はこれら疾患の治療を助けるのに使えるだろう。ただ残念ながらこれら3つの型の活性部位はほとんど同じであるため、違いがある領域にまで到達するより大きな薬剤の設計に力が注がれている。上図下のボタンをクリックして対話的操作のできる画像に切り替え、誘導性NOS(PDBエントリー 1nod)、内皮性NOS(PDBエントリー 2nse)、神経性NOS(PDBエントリー 1om4)それぞれの触媒ドメイン、および活性部位に阻害剤が結合したNOS(PDBエントリー 3e7t)の構造を比較してみて欲しい。
理解を深めるためのトピックス
- 一酸化窒素合成酵素はある種の細菌も作っています。Sequence Navigator や Structure Navigator を使って細菌の酵素と哺乳類の酵素を比較することができます。
- PDBには一酸化窒素合成酵素に薬剤の試作品が結合した構造が多数登録されています。これらの薬剤分子が酵素および酵素補因子とどのように相互作用しているのかを調べるのに米国RCSBの「Ligand Explorer」を使うことができます。
参考文献
- 2010 NO synthase: structures and mechanisms. Nitric Oxide 23 1-11
- 2010 Bacterial nitric oxide synthases. Annual Review of Biochemistry 79 445-470
- 2010 Subcellular and cellular locations of nitric oxide synthase isoforms as determinants of health and disease. Free Radical Biology and Medicine 49 307-316
- 2008 Anchored plasticity opens doors for selective inhibitor design in nitric oxide synthase. Nature Chemical Biology 4 700-707
- 2006 Soluble guanylate cyclase. Current Opinion in Structural Biology 16 736-743
- 2005 Structure-function studies on nitric oxide synthases. Journal of Inorganic Biochemistry 99 293-305
- 2004 Radical reactions of nitric oxide synthases. Biochemical Society Symposium 71 39-49
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









