230: 開始因子eIF4E(Initiation Factor eIF4E)
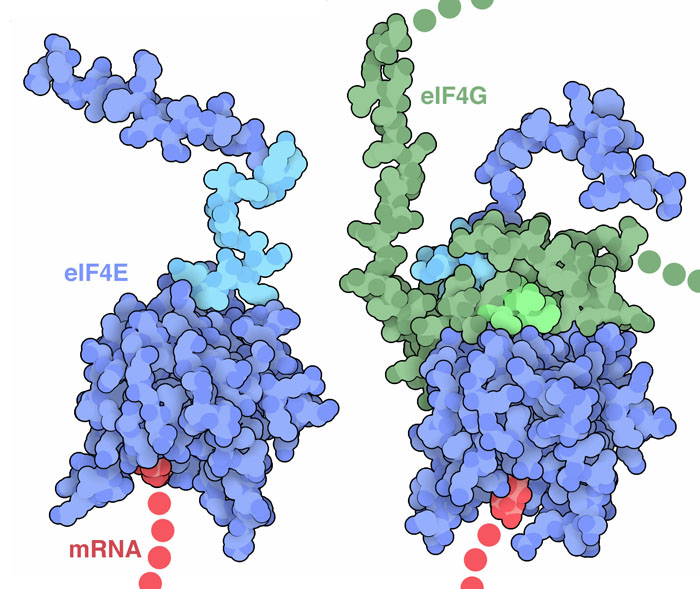
タンパク質の合成過程は複雑で、細胞がその過程を始めるにはある手法が必要である。一連の開始因子(initiation factor)は伝令RNA(messenger RNA)、リボソーム(ribosome)、最初の転移RNA(transfer RNA)を集め、新たなタンパク質の構築を始める上で必要なものをすべて準備する。私たちの細胞やそのほかの真核生物において、ほとんどの伝令RNA分子にはメチル化されたグアニンヌクレオチド(methylated guanine nucleotide)がついている。ついている場所は鎖の最初で、向きは逆向きである。開始因子eIF4E(initiation factor eIF4E、PDBエントリー1ej1)はこの一般的なキャップ構造を認識し、開始因子の残り部分を伝令RNAのところに集める役割をする。
条件つきで一定の構造をとるdisorder領域
私たちの細胞は、タンパク質の中にある柔軟な領域を利用して信号伝達と認識を行うための複合体をつくることがよくある。タンパク質が単独で存在するときはその末端が定まった構造を取っていないが、複合体を形成すると小さくて局所的に相互作用する構造へと折りたたまれる。eIF4E(PDBエントリー1ap8)は伝令RNAキャップに結合するコンパクトなドメインと、長く柔軟な尾部とで構成されている。eIF4EがeIF4G(開始因子の一種で、他の開始因子にとっての足場として働く)と相互作用するとき、この尾部の一部分が折りたたまってeIF4G(PDBエントリー1rf8)の似た柔軟領域と相互作用する。
がんとのつながり
がん細胞は急速に成長するが、そのためには通常の細胞に対する成長制御を回避する必要がある。その回避策の一つは、eIF4Eを過剰に活性化させるなどの方法により、タンパク質合成を制御する機械に発がん性変化を起こすというものである。現在、eIF4Eの作用を遅らせてがん細胞の成長が促進されないようにする阻害剤を開発する研究が進められている。
開始の相互作用
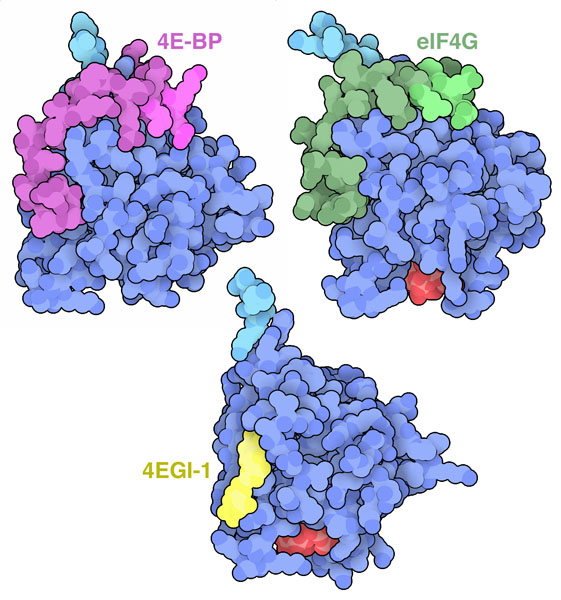
構造生物学者はeIF4Eとその結合相手の相互作用を詳しく調べ続けている。eIF4Eタンパク質は、4E結合タンパク質(4E Binding Protein、4E-BP)と結合した不活性な状態で蓄えられる。必要になると4E-BPはリン酸化されて放出され、その同じ場所にeIF4Gが結合する。PDBエントリー1ejhと1ej4の構造によって、これらのタンパク質が似た疎水性モチーフを使ってどのようにeIF4Eと結合しているのかが示された。また後に解かれた2つの構造(PDBエントリー5t46、4ued)はeIF4Gと4E結合タンパク質の大きな一部分を見たもので、条件つきで一定の形をとって相互作用する際に隣接する部分も重要であることを示している。試作品の抗がん阻害剤4EGI-1はeIF4E上の同じ場所に結合し、本来の結合相手が結合するのを妨げる(PDBエントリー4tpw)。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
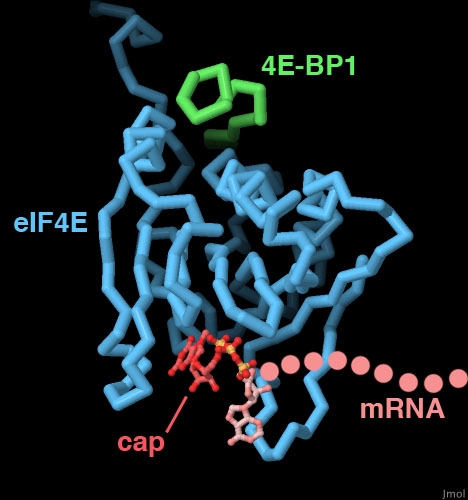
PDBエントリー1wkwには伝令RNAの先端にある、一つのヌクレオチドとキャップが含まれている。キャップには、一般的な鎖の方向とは逆を向いたグアニンがあり、さらにメチル基が付加されている。この構造には4E結合タンパク質の短い断片が含まれ、この中にはeIF4Eによって特異的に認識される疎水性の伸びた部分がある。画像の下のボタンをクリックして対話的操作のできる画像に切り替え、この構造をより詳細に見てみて欲しい。
理解を深めるためのトピックス
参考文献
- 5t46 2016 The Structures of eIF4E-eIF4G Complexes Reveal an Extended Interface to Regulate Translation Initiation. Mol.Cell 64 467-479
- 4ued 2015 Molecular Architecture of 4E-BP Translational Inhibitors Bound to Eif4E. Mol.Cell 57 1074
- 4tpw 2014 Structure of the eukaryotic translation initiation factor eIF4E in complex with 4EGI-1 reveals an allosteric mechanism for dissociating eIF4G. Proc.Natl.Acad.Sci.USA 111 E3187-E3195
- 1rf8 2003 Ribosome loading onto the mRNA cap is driven by conformational coupling between eIF4G and eIF4E. Cell 115 739-750
- 1ejh、1ej4 1999 Cap-dependent translation initiation in eukaryotes is regulated by a molecular mimic of eIF4G. Mol.Cell 3 707-716
- 1ej1 1997 Cocrystal structure of the messenger RNA 5' cap-binding protein (eIF4E) bound to 7-methyl-GDP. Cell 89 951-961
- 1ap8 1997 Structure of translation factor eIF4E bound to m7GDP and interaction with 4E-binding protein. Nat.Struct.Mol.Biol. 4 717-724
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









