228: 酵素の指向性進化(Directed Evolution of Enzymes)
ダーウィンの生物進化論(Darwin’s conception of biological evolution)は2つの異なる過程をつなげたものである。まず、集団の中で遺伝的変異や組み換えのようなランダム変異をたくさん起こす過程が必要である。そして生物学的進化は、適者生存(survival of the fittest)というよく知られた考えを通して、自然選択により方向づけられる。この二つの過程をつなぎ、何世代にも渡って最適な個体の選択を繰り返すことが、より良い特徴の進化につなる。今日、これと同じ進化過程を実験室内で用い、困難な問題の解決に役立てられている。
指向性進化法
2018年にノーベル化学賞を受賞したフランシス・アーノルド(Francis Arnold)は、進化を利用し全く新しい機能を持った酵素をつくる方法を開発した。これは生物学的進化と似ている部分が多いが、進化の方向は科学者が決める。過程は適切な「元となる」酵素を見つけることから始まるが、その酵素は弱いながらも希望する反応を行っていたり、似た反応を行ったりするものであることが多い。次に、その元酵素に変異が加えられるが、その場所は多くのランダムな変異を生み出すことがタンパク質の立体構造情報から分かった部位であることが多い。変異した酵素は望む活性を持っているかテストされ、最も性能のよかったものを選ばれる。この変異とテストを繰り返していくと、 望む機能を持った進化型酵素が得られる。
巧妙な化学反応
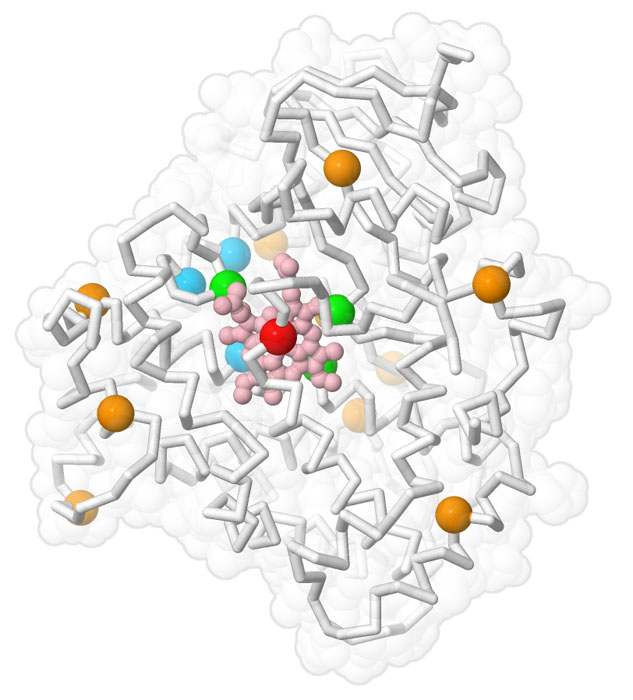
ここに示す酵素(PDBエントリー5ucw)は指向性進化法(directed evolution)によって産み出されたものである。この酵素は天然の酵素が行わない巧妙なアミノ化反応を行うが、産業的な環境ではロジウム、ルテニウム、イリジウムなどの貴金属触媒を必要とする。これをつくる指向性進化法はシトクロムp450(cytochrome p450)の酵素を元にして始められた。新たにセリンを加えて鉄原子に配位させ、この他にもさまざまな変化を加えて、この酵素が行う反応の型を調整した。その結果できたのは、金属触媒を必要とせず環境にやさしい酵素であった。しかも望んだ反応物に対する選択性は高かった。
Building Drugs
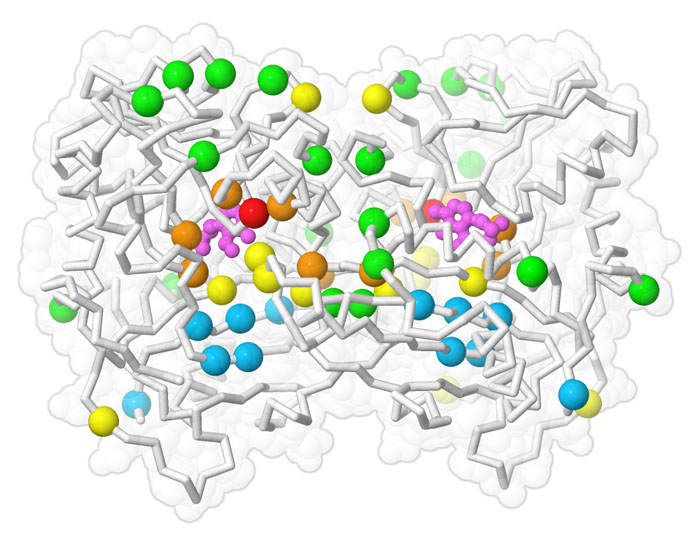
指向性進化法は、扱いづらい中間体分子をつくれるよう酵素を進化させるのにも用いられた。この中間体は糖尿病治療薬のシタグリプチン(sitagliptin)をつくるときに必要となるもので、特別なロジウム触媒を使った高圧水素付加を必要とする伝統的な化学合成法に代わる方法の開発につながった。この新たな酵素は、まず反応を調整し、次に高圧の有機溶媒がある工業的条件での能力調整を行い、全部で11の段階を経てつくられた。その結果できた酵素をここに示す(PDBエントリー3wwj)。これは非常に純度の高い生成物をつくりだすので精製処理を減らすことができ、より環境にやさしく製造できる。
天然物の機能拡張
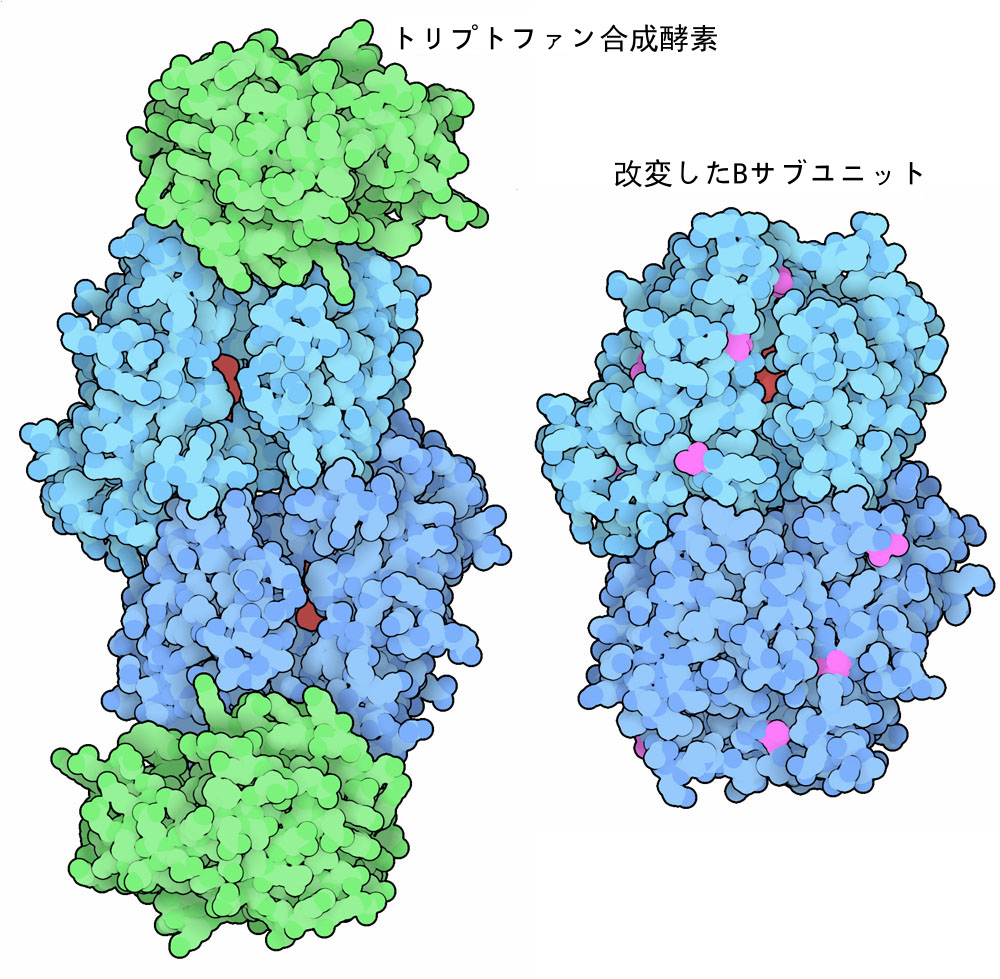
天然タンパク質のほとんどは20種類のアミノ酸(とこの標準アミノ酸の変異型数種類)でできているが、生物学的研究ではこの他のさまざまなアミノ酸を使って新たな薬や分子診断薬をつくる。ここに示す改変型酵素(PDBエントリー6am8)は、修飾型トリプトファンをつくる。この酵素は、指向性進化法を使い天然のトリプトファン合成酵素(PDBエントリー1wdw)から数段階を経てつくられた。この天然酵素には異なる2つの反応を行う2種類のサブユニットが含まれるが、まずは中央に示す酵素(Bサブユニット)を修正し、もう一方の酵素(Aサブユニット)がなくても働くようにした。そしてさらに変異を進め、酵素が行う反応を変化させた。できた酵素の分子構造を調べた結果、変異の影響は酵素全体に広がっており、活性部位で目的の基質と直接相互作用しているのではなく酵素の柔軟性を変化させていることが分かった。
指向性酵素への補因子結合
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
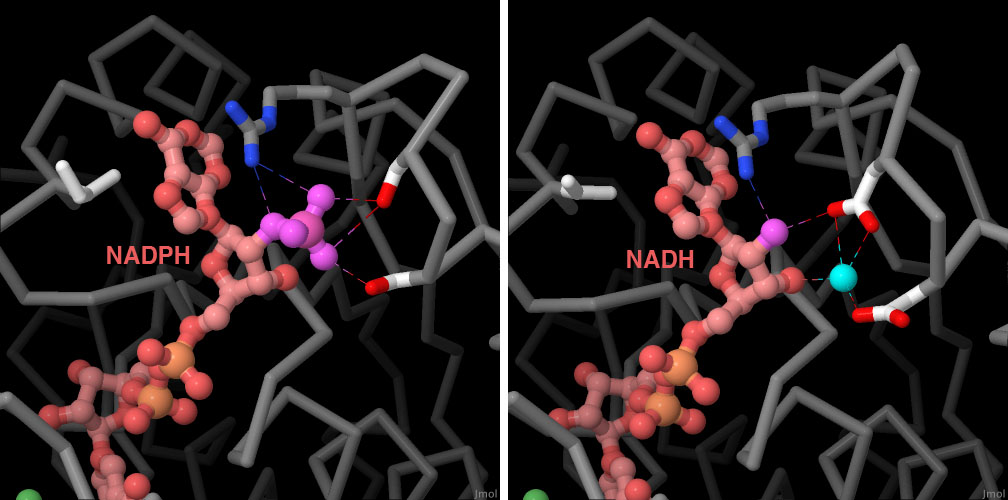
指向性進化法は細胞での生化学的過程を調整するのにも用いられる。たとえば、アーノルドの研究室では、第2世代バイオ燃料の一つイソブタノール(isobutanol)の産生過程を調整した。イソブタノール産生過程にはアルコール脱水素酵素(alcohol dehydrogenase)とKARI(ketol-acid reductoisomerase、ケトール酸還元異性化酵素)という2つの酵素が関わっており、これらは補因子のNADPHを使う。しかし、細胞内ではこれと似た補因子NADHの方がより一般的にみられる。なぜなら細胞はエネルギーの多くを解糖系(glycolysis)でつくるからである。そこでアーノルドと彼女のチームは指向性進化法を使って、NADPHではなくNADHを使うように酵素を修正した。アルコール脱水素酵素については、他の生物で見つかったNADHを使う変異型を改変し、この反応過程で最も適した機能を持つようにした。一方、KARIについてはNADPHを利用する天然の酵素から進化させ、利用する補因子をNADHに切り替える必要があった。このような補因子を切り替える改変をKARI酵素に適用した構造をここに示す。左が元の酵素(PDBエントリー4kqw)、右がNADH依存性の改変型酵素(PDBエントリー4kqx)である。図の下のボタンをクリックし、対話的操作のできる画像に切り替えてより詳しくみてみて欲しい。
理解を深めるためのトピックス
- Many other examples of directed evolution, both for enzymes and for other proteins, are available in the archive. Try searching for “directed evolution” to see some of them. 酵素だけでなくその他のタンパク質についても、指向性進化法の例が他にもたくさんあり、PDBに登録されています。指向性進化法で検索しそれらを見てみてください。
- 分子進化に関する他の記事も見てみてください(英語)。
参考文献
- Directed evolution: bringing new chemistry to life 2018 Angewandte Chemie International Edition 57 4143-4148
- 6am8 Directed evolution mimics allosteric activation by stepwise tuning of the conformational ensemble. 2018 Journal of the American Chemical Society 140 7256-7266
- 5ucw Enantioselective, intermolecular benzylic C–H amination catalysed by an engineered iron-haem enzyme. 2017 Nature Chemistry 9 629-634
- 3wwj A new target region for changing the substrate specificity of amine transaminases. 2015 Scientific Reports 5 10753
- 4kqw、4kqx General approach to reversing ketol-acid reductoisomerase cofactor dependence from NADPH to NADH. 2013 Proceedings of the National Academy of Science USA 110 10946-10951
- Biocatalytic asymmetric synthesis of chiral amines from ketones applied to sitagliptin manufacture. 2010 Science 329 305-309
- 1wdw Conformational changes in the tryptophan synthase from a hyperthermophile upon alpha(2)beta(2) complex formation: crystal structure of the complex. 2005 Biochemistry 44 11417-11427
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









