224: レグマイン(Legumain)
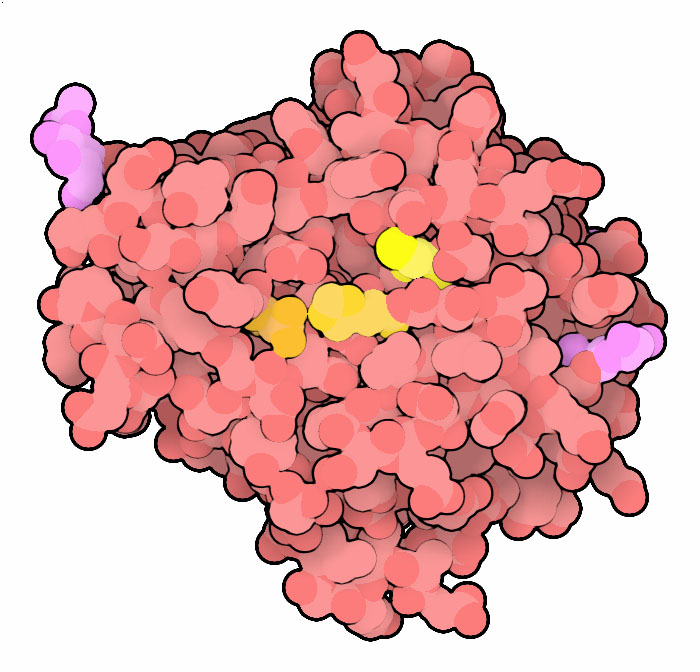
レグマインにはさまざまな機能があり、そのことを反映し多くの名前がある。植物では、タンパク質を液胞に貯蔵するのを助けるので液胞処理酵素(vacuolar processing enzyme)と呼ばれる。私たちの細胞では、免疫系のためのタンパク質を処理し主要組織適合性複合体(major histocompatibility complex、MHC)によって提示される短いペプチドを作り出す。このタンパク質は、アスパラギンの後ろでタンパク質を切断するという特徴を持っていることからアスパラギン エンドペプチダーゼ(asparaginyl endopeptidase)と呼ばれている。また、タンパク質鎖の末端でアミノ酸を切断する働きもあり、その機能に対応した別の名前もつけられている。幸いなことに、研究の世界ではこれらすべての働きを行う酵素に対しレグマイン(legumain)というより簡単な名前で呼ぶ方向に落ち着きつつある。
システインによるハサミ
レグマイン(ここに示すのはPDBエントリー4awbの構造)はアミノ酸のシステインを使い、ヒスチジンとアスパラギンの助けも借りてタンパク質を切断する反応を行う。しかしこれら3つのアミノ酸の並べ方は、セリンプロテアーゼ(serine protease)でよく見られる3つ組触媒残基の並びとは異なっている。セリンプロテアーゼの場合、この3つのアミノ酸は切断対象となるタンパク質の一方の側に並ぶが、レグマインの場合、システインとヒスチジン・アスパラギンは反対の側から攻撃する。カスパーゼ(caspase)の触媒残基もセリンプロテアーゼと似た並びになっているが、システインプロテアーゼの一つパパイン(papain)の方がより似た並びになっている。レグマインにも小さな特徴的なくぼみがあって、ここには負の電荷を帯びたアミノ酸2つと正の電荷を帯びたアミノ酸2つがある。これらのアミノ酸が切断対象のタンパク質にあるアスパラギンを認識し、レグマインが正しい位置でのみ切断するようにしている。
切り取りと貼り付け
驚くべきことに、レグマインをさらに調べるとタンパク質鎖を再接続することにも非常に長けていることが明らかになった。例えば、コンカナバリンA(concanavalin A)の循環置換に関係していたり、植物が防御のために使う環状ペプチドをつくるのを助けていたりする。この結合反応は切断反応と同じ活性部位で起こるが、アミノ酸のシステインは使われないようである。代わりに近くにあるアスパラギン酸が珍しい化学形(後に示す対話的操作のできる図参照)をとり、これが反応を助けていると考えられている。
プロテアーゼの安全性
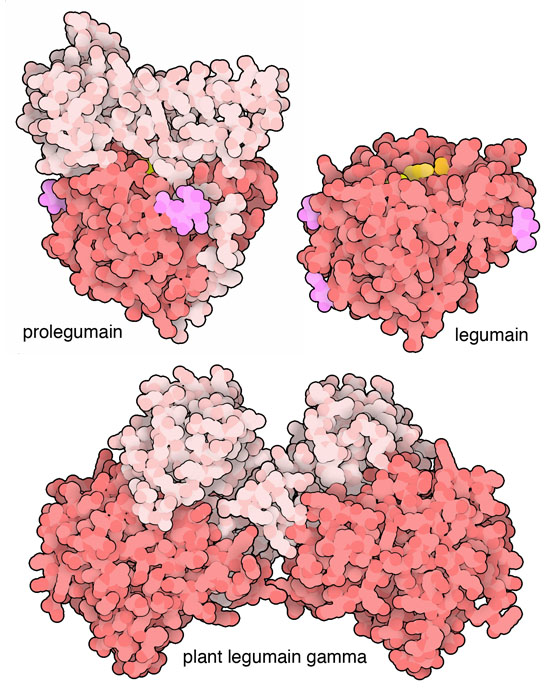
プロテアーゼは適切に制御されていないと細胞にとっては危険な存在となり得る。レグマインはまず、不活性型の酵素前駆体としてリボソーム(ribosome)によってつくられる。この前駆体には活性部位をふさぐ長い阻害作用部位がついている。通常、レグマインは液胞やエンドソーム(endosome)で機能するが、これらの場所で別のタンパク質切断酵素がこの余分な部分を切断することでレグマインは活性化される。植物由来のレグマインの一種(PDBエントリー5nij)ではこの成熟過程にさらなる段階が加わる。切断された分子は集まって、二量体もしくはより多くの分子が集まった集合体となり、必要となるまで小胞体(endoplasmic reticulum)に貯蔵される。
構造をみる
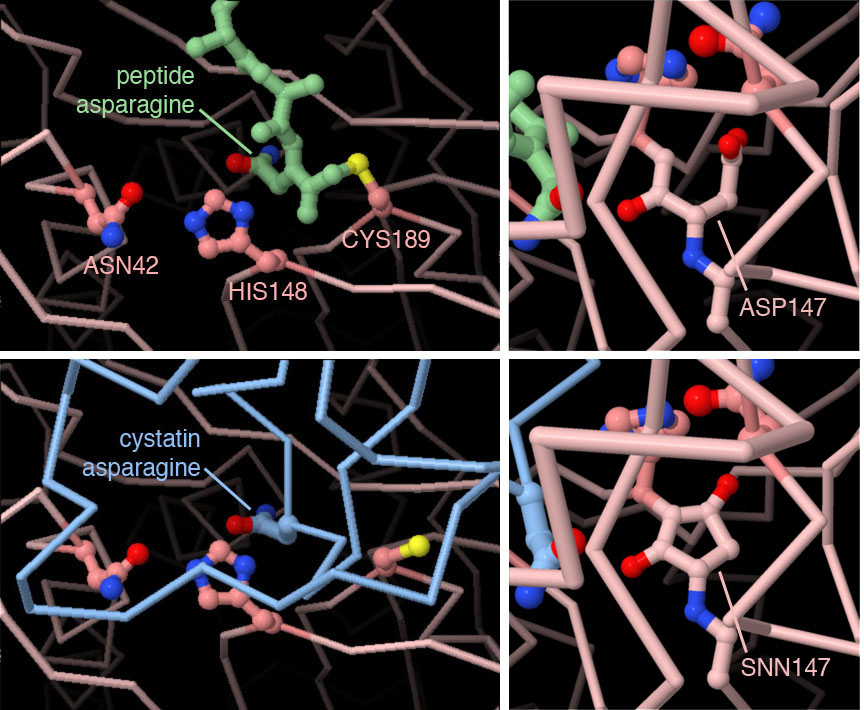
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
PDBエントリー4awbの構造は、レグマインの反応途中の様子をとらえている。 左上の図では、短いペプチドは切断されているが、一方の断片はまだ触媒するシステインに付加されたままになっている。この後、水分子を使って付加されたペプチドは解放される。PDBエントリー4n6oの構造では、レグマインが阻害タンパク質のシスタチン(cystatin)と結合している。左下に示すように、シスタチンも特異的なくぼみにはまるアスパラギンを持っているが非常にゆっくりとしか切断されない。そして切断されるとレグマインによって再びつながれる。その右の図で示す構造は珍しいアミノスクシンイミド(aminosuccinimide)型をとっていて、これが結合反応に重要であると考えられている。図の下のボタンをクリックして対話的操作のできるJSmol画像に切り替え、特異的なくぼみと修飾されたアスパラギン酸を見てみて欲しい。
理解を深めるためのトピックス
参考文献
- 5nij 2018 Crystal structure of plant legumain reveals a unique two-chain state with pH-dependent activity regulation. Plant Cell 30 686-699
- 2016 Structure and function of legumain in health and disease. Biochimie 122 126-150
- 4n6o 2015 Structure and mechanism of an aspartimide-dependent Peptide ligase in human legumain. Angew. Chem. Int. Ed. Engl. 54 2917-2921
- 4awb、4fgu 2013 Mechanistic and structural studies on legumain explain its zymogenicity, distinct activation pathways, and regulation. Proc. Natl. Acad. Sci. USA 110 10940-10945
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









