225: フィターゼ(Phytase)
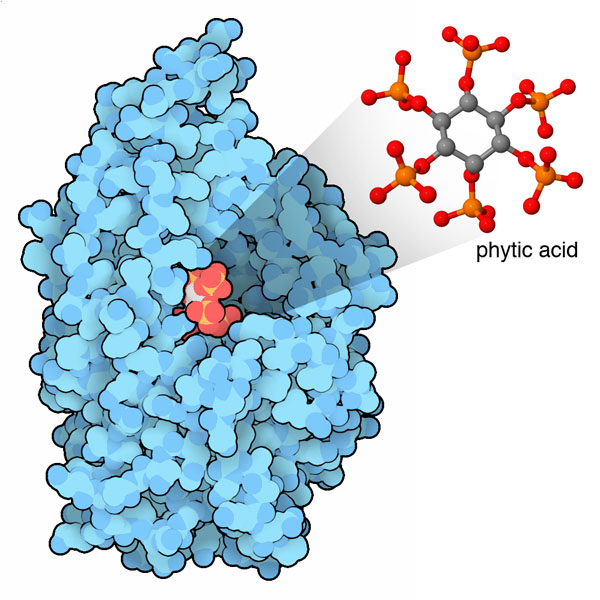
競争がある生態系では、使えるリンの量によって成長に制約が生じるのは珍しいことではなく、生き物はそれを分け合う方法を見つけてきた。私たちは食物からリンを摂取しているが、それはヌクレオチドやリン酸イオンなどの役に立つ分子の中にうまく取り込まれている。植物は手元にめぐってくる資源だけでやっていく必要があり、フィチン酸(phytic acid、専門的にはイノシトール6リン酸 inositol hexakisphosphate)と呼ばれる珍しい分子にリンを貯蔵していることがよくある。この分子は安定で、有用な分子へと分解する適当な酵素がない限りほとんど消化されない。このことは農業において特別な問題を引き起こす。
飼料に含まれるリン
家畜には大豆など植物中心の飼料が与えられることがよくあるが、これにはフィチン酸が豊富に含まれている。多くの胃を持つウシは、フィチン酸を分解し栄養として使えるリン酸分子にしてくれる細菌を持っている。一方、ブタやニワトリは胃を一つしか持っていなくて、ほとんどのフィチン酸は素通りしてしまう。この制約によって2つの問題が生じる。一つは動物の生育に他のリン酸源が必要になることである。そしてもう一つは、肥料に含まれるフィチン酸が環境中に放出されると有毒な藻類が繁茂してしまうなどのの問題を引き起こしてしまうことである。この二つの問題を解決するため、家畜の飼料には酵素のフィターゼ(phytase)がよく添加されている。この酵素は動物の胃でフィチン酸を分解してくれる。
フィターゼ
フィターゼは小さく酸に対し安定な酵素で、フィチン酸から徐々にリン酸基を取り出す。飼料への添加物としてよく使われるのは主に次の2種類である。互いに似ているが一方は細菌由来でここに示すのはPDBエントリー1dkqの構造、もう一つはカビ由来でここに示すのはPDBエントリー1ihpの構造である。バイオテクノロジーの業界ではより熱に安定で活性の高いフィターゼを作り出し、より大規模に農業で利用できるようにする懸命な努力が続けられている。
さまざまなタイプのフィターゼ
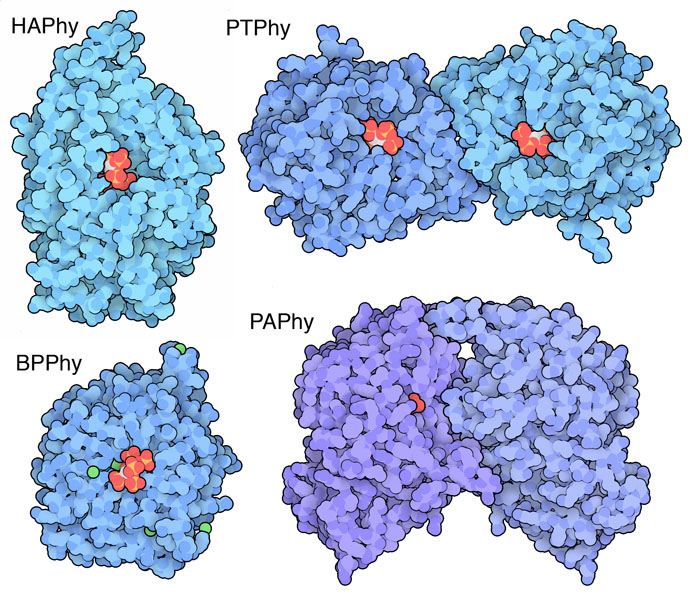
非常に多くの生き物が植物を食べるので、さまざまな種類のフィターゼが進化してきたことは別に驚くようなことではない。研究者は構造に基づいてこれらを4つのグループに分類した。ヒスチジン酸フィターゼ(Histidine Acid Phytase、HAPhy)は飼料に添加されるフィターゼに似ていて、反応を行うヒスチジンを持っている。β-プロペラフィターゼ(Beta-Propeller Phytase、BPPhy、PDBエントリー3amr)はその珍しい折りたたみ様式から名づけられた。PDBエントリー3mmjのようなPTPhyフィターゼはタンパク質のチロシン脱リン酸化酵素(Protein Tyrosine phosphatase)と似ている。紫色酸性フィターゼ(Purple Acid Phytase、PAPhy、PDBエントリー4kbp)は金属イオンを含んでおり、紫色をしている。
構造をみる
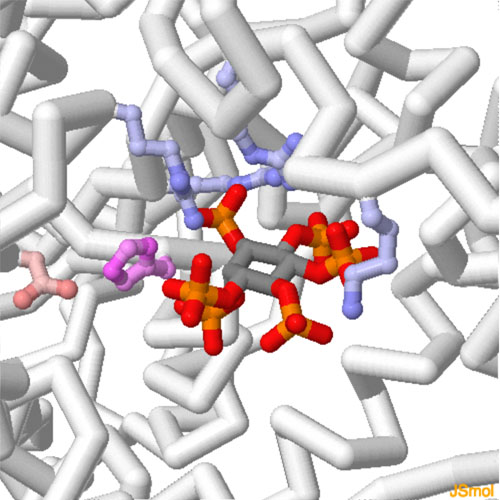
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
大腸菌から得られたフィターゼの一種AppAは反応の際にヒスチジン(赤紫色の部分)を使う。これは隣接するアスパラギン酸(ピンク色)によって活性化される。フィチン酸にはたくさんのリン酸基(赤とオレンジで示す部分)があるため強い負の電荷をもっている。それにより、正の電荷をもったアルギニンとリジン(青で示す部分)の並びによって認識され配置が行われる。図の下のボタンをクリックして対話的操作のできる画像に切り替え、構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
- フィチン酸は特に抗酸化作用があることから、細胞の中でさまざまな他の機能も担っていると考えられています。イノシトール6リン酸(inositol hexakisphosphate)のリガンドページでは、これに結合する他のタンパク質の構造ページへのリンクがあります。
- イノシトールリン酸マルチキナーゼで検索すると、フィチン酸をつくる酵素を見つけることができるでしょう。
参考文献
- 2013 Phytase, a new life for an “old” enzyme. Annual Review of Animal Bioscience 1 283-309
- 3mmj 2012 Substrate binding in protein-tyrosine phosphatase-like inositol polyphosphatases. Journal of Biological Chemistry 287 9722-9730.
- 3amr 2011 Crystal structures of Bacillus alkaline phytase in complex with divalent metal ions and inositol hexasulfate. Journal of Molecular Biology 409 214-224.
- 1dkq 2000 Crystal structures of Escherichia coli phytase and its complex with phytate. Nature Structural and Molecular Biology 7 108-113
- 4kbp 1996 Mechanism of Fe(III)-Zn(II) purple acid phosphatase based on crystal structures. Journal of Molecular Biology 259 737-748
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









