205: 核膜孔複合体(Nuclear Pore Complex)
細菌の細胞は速さを目的としてつくられ、一方私たちの細胞は複雑さを目的としてつくられる。私たちの体には非常に多種多様な細胞があり、さまざまな機能を持っている。そのため、細菌よりも高度な制御が必要となる。この目的を達成するため、私たちの細胞は核内でDNAから伝令RNAを作る転写と、細胞質で伝令RNAからタンパク質をつくる翻訳の2段階にタンパク質の合成過程を分割した。この分割によって、伝令RNAへのキャッピングやスプライシングといったさらなる制御を加えることができる。核膜孔複合体(nuclear pore complex、NPC)は核膜に埋まった大きなチャネルで、これら2つに分かれた過程をつなげている。これにより核と細胞質の間で、核酸とタンパク質を双方向に輸送することができる。
核膜孔複合体の構造
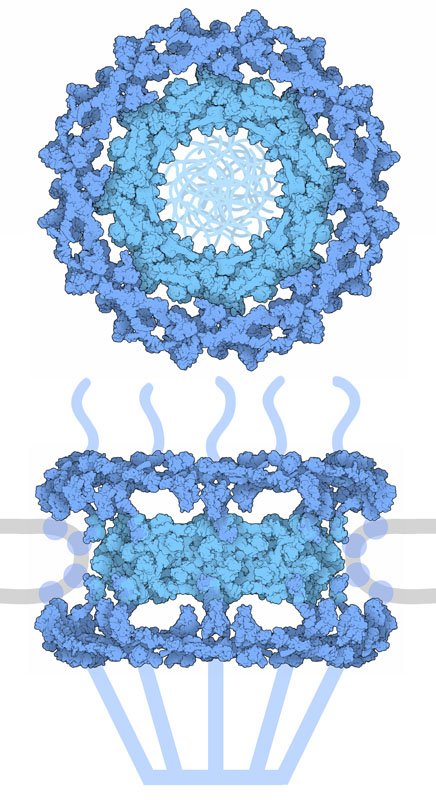
核膜孔複合体は、ヌクレオポリン(nucleoporin)と呼ばれるタンパク質が何百個も集まってできた巨大な分子複合体である。対称性のある中心部は、構造を支える外側の輪と、輸送チャネルをつくる内側の輪とでできている。あまり対称性がないその他の部分は孔の両側にあって、分子を取り扱っている。構造体全体では毎秒1000分子を輸送することができ、分子のサイズもタンパク質からリボソームサブユニット全体まで対応できる。
核膜孔複合体の研究
核膜孔複合体全体の構造はかなり大きく活動的なので、「分割統治」の方法を使って構造の解明が行われた。ヌクレオポリン単体と、複合体の一部についての結晶構造がそれぞれ原子レベルの解像度で解かれ、核膜孔複合体全体の骨格に関するマップデータが電子顕微鏡で得られた。このマップの情報は、個々の原子を識別できる程の解像度はないが、タンパク質全体をみるには十分である。この原子レベルの部品構造と全体の電子密度マップを統合して全体の構造が得られた。ここに示す図は、これらの統合構造のうちの2つをつなげ、孔中心の基盤部分をみられるようにしたもので、外側の輪はPDBエントリー5a9q、内側のチャネルを構成する環状部分はPDBエントリー5ijnの構造である。
分子の輸送
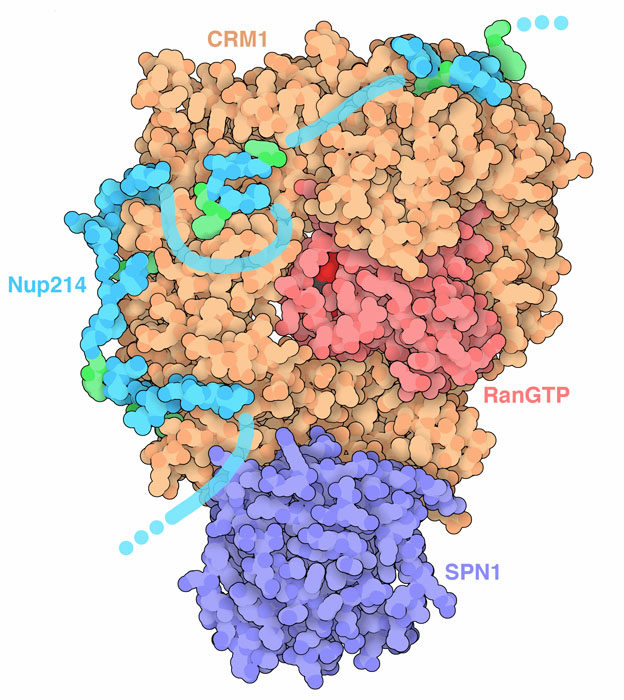
核膜孔複合体の中心にある拡散チャネルは、核と細胞質との間における分子の行き来を制御する。低分子は自由に孔を通過できるが、高分子は積極的に運ぼうとしなければ通過できない。カリオフェリン(karyopherin)と呼ばれる輸送タンパク質は、まだ決まった構造をとらず輸送チャネルに伸びているヌクレオポリン鎖(PDBエントリー5dis)と相互作用する。このタンパク質は、ヌクレオポリンの鎖中に何度も繰り返し現れるフェニルアラニン-グリシンの配列(FGリピート)に結合する。カリオフェリンは、このFGリピートにおける一時的な相互作用を通して、運んでいる分子と一緒にチャネルを移動する。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
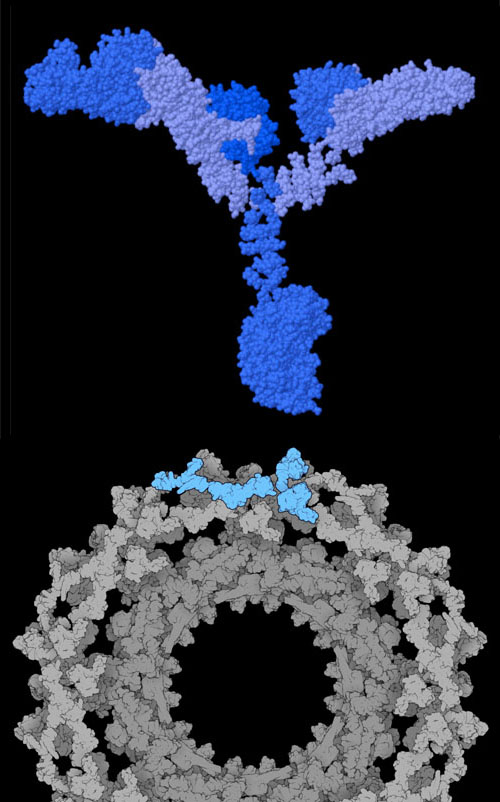
外被ヌクレオポリン複合体(coat nucleoporin complex)は、対称的な形をした核膜孔複合体中心部の一部分である。酵母の場合、外被ヌクレオポリンは集まってY字型の複合体をつくる。上図上にに示すのはその一つでPDBエントリー4xmmの構造である。そして多くの外被ヌクレオポリン複合体が集まって4つの八員環をつくる。上図下に示すのはそのうちのひとつで、ヒト由来の複合体である。Y字型をした複合体の腕部が隣接する分子をつかみ、輪全体が一体となるよう固定している。図の下にあるボタンをクリックして対話的操作のできる画像に切り替え、酵母由来の複合体をより詳しく見てみて欲しい。
理解を深めるためのトピックス
参考文献
- 2016 Toward the atomic structure of the nuclear pore complex: when top down meets bottom up. Nature Structural & Molecular Biology 23 624-630
- 5ijn 2016 Molecular architecture of the inner ring scaffold of the human nuclear pore complex. Science 352 363-365
- 2016 The structure inventory of the nuclear pore complex. Journal of Molecular Biology 428 1986-2000
- 5dis 2015 Structural and functional characterization of CRM1-Nup214 interactions reveals multiple FG-binding sites involved in nuclear export. Cell Reports 13 690-702
- 4xmm 2015 Nuclear pores. Architecture of the nuclear pore complex. Science 347 1148-1152
- 5a9q 2015 In situ structural analysis of the human nuclear pore complex. Nature 526 140-143
- 2011 The structure of the nuclear pore complex. Annual Review of Biochemistry 80 613-643
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









