206: グロビンの進化(Globin Evolution)
チャールズ・ダーウィン(Charles Darwin)が進化説を考案した時、細胞内部での働きについてまだ多くのことが分かっていなかった。生物集団は自然選択の下で進化するという彼の画期的な考えは、周囲で目にした動植物の観察に基づくところが大きかった。進化の内部的なしくみは、後になって遺伝情報、親から子への遺伝、変異について詳しいことが解明されてから分かってきたものである。今日では、豊富なデータにふれ、進化の背後にあり基礎となる分子生物学を見て理解することができる。
生命の樹
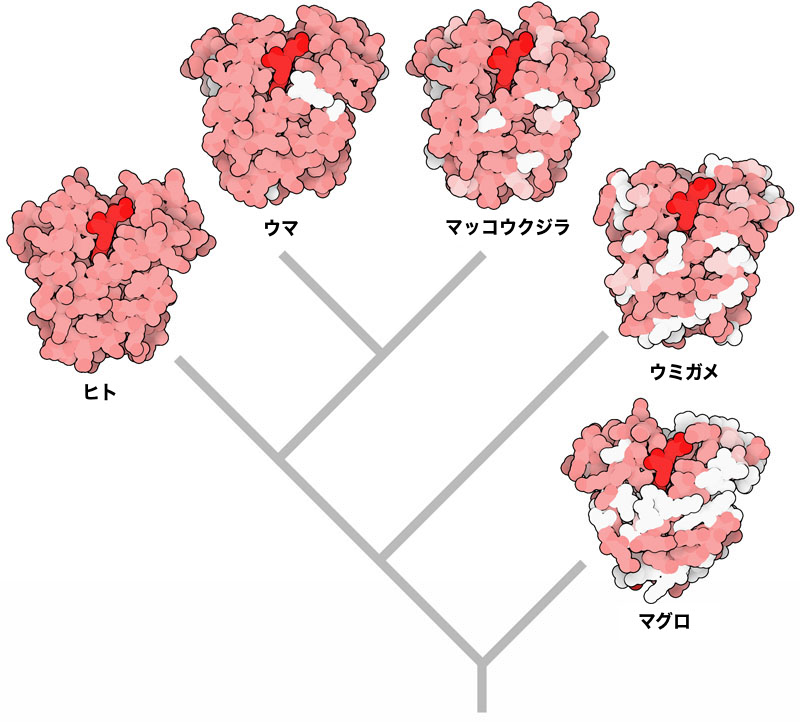
生物学者が生物を詳しく見始めた当初から、地球上に生息しているあらゆる生物は何か関係していることは明らかだった。多くの共通する特徴を持つウマとウシのように近縁なものもあれば、ヒトデとゾウのようにかなりの違いがある縁遠いものもいる。どれだけ似ているのかを詳しく分析して生命の樹(系統樹)というものがつくられた。これは似た生物を同じ枝に集め、似ていない生物は離れた枝に配置して描いた樹形の図である。今日、これら生物の遺伝配列を調べることにより、この図をより定量的に描くことができるようになっている。遺伝配列の違いが蓄積していく速度と生物進化の速度がおおよそ等しいと仮定するなら、その遺伝配列がどれだけ違うかという情報に基づいて系統樹をつくることができる。
グロビンの進化
この種の樹形図をかく上で必要となるのは、研究対象としている全ての生物にとって不可欠なタンパク質である。このタンパク質に対応する遺伝子は対象生物全てが持つことになる。ここに示す系統樹はタンパク質のミオグロビン(myoglobin)を使い、対象を脊椎動物に限定して描いたものである。見ての通り、私たちと最も近縁な
グロビンの変異
ダーウィンの進化説は、生物群がさまざまな特徴を持つ個体で構成されていて、その特徴の中にはある特定の環境下において有利となり選択されるものがあるという考えに基づいている。この多様性は、ゲノムが変異し機能がわずかに変化したタンパク質ができることによって生み出される。この種の変異に関する事例はたくさんあり、PDBに登録されたデータの中からも多数挙げることができる。例えば、水生哺乳類が持つミオグロビンは一般的なミオグロビンよりも高密度に詰め込むことができ、より多くの酸素を蓄えて長時間の潜水に役立てることができる。また、1ヶ所の変異によって生み出されるヒト鎌形赤血球ヘモグロビン(hemoglobin)は病気を引き起こすが、同時にマラリア感染に対する抵抗性を高めてくれる。
進化のしくみ
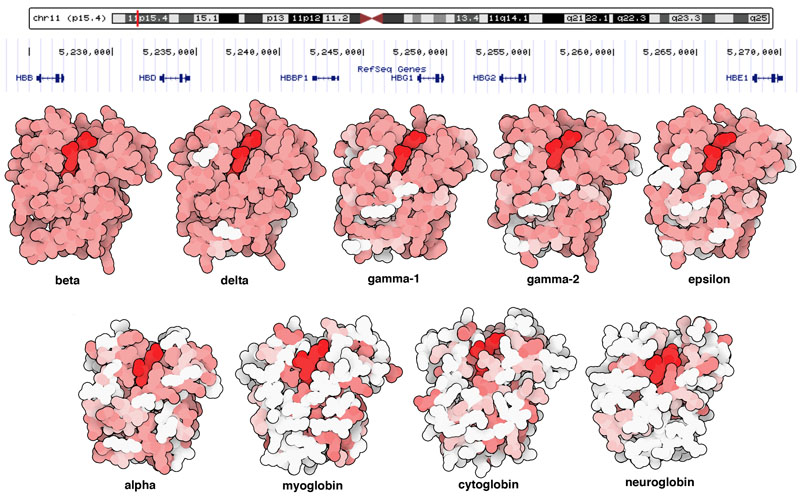
ゲノム配列とタンパク質の構造をよくみたとき、進化のしくみについてもいくつかわかることがある。例えば、あるタンパク質が進化するというのは想像しにくいかもしれない。なぜなら生物が生きるためには常に活性を保っておく必要があるからである。だがゲノムをみると、この問題は多くの場合ゲノム複製を通して解消されていることがわかる。ある遺伝子の複製をつくり、この複製を使えば生物を傷つけることなく自由に進化させることができる。グロビンの場合、これがはるか昔に繰り返し起こっている。私たちのゲノムには、数種類のヘモグロビンβ鎖変異体をコードする遺伝子群がある。例えば、
昔のグロビンの再現
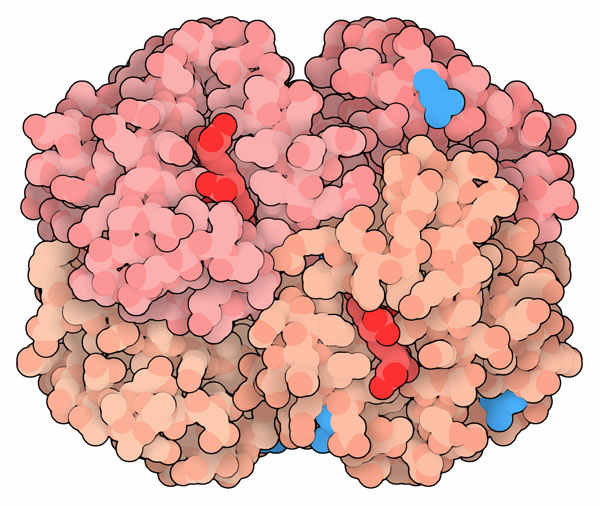
特別な条件がそろえば、歴史をさかのぼって生命の進化を調べることができる。シベリアで凍った状態にて見つかったマンモスの骨から得られたDNAを使って、この絶滅種に由来するヘモグロビンのα鎖とβ鎖の遺伝子を再構築し、細菌を使ってタンパク質の合成が行われた(PDBエントリー3vrf)。マンモスのグロビンの進化は現代のゾウが持つグロビンの進化と極めて似ているが、この小さな変化によって低温でより良く機能することが分かった。またこの配列は、アフリカゾウよりもアジアゾウに近縁な種であるとする他の研究結果を支持する内容となっている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
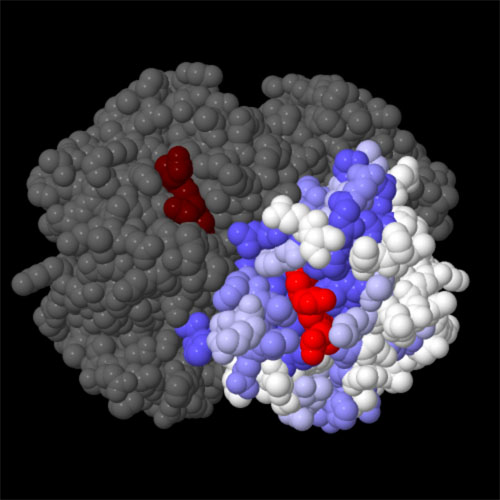
分子生物学者は、保存度(conservation)を使って進化的変異をみることがよくある。不可欠な機能を持つタンパク質の領域は、異なる生物をみても非常に似ている。一方、補助的な役割をしている領域はかなり違っていることも珍しくない。ここに示すヘモグロビン(PDBエントリー2hhb)β鎖は保存度によって色分けしている。計算はオンラインConSurfサーバを使い、数百種の生物の配列に基づいて行った。ご覧の通り、サブユニット間の接触やヘムが入る場所の整列に関わる領域は保存度が高い(濃い青で示す部分)。一方、タンパク質の外縁部(白で示す部分)はそれほど保存度は高くない。図の下のボタンをクリックし、対話的操作のできる画像に切り替えるとより詳しくみることができる。
理解を深めるためのトピックス
- RCSB PDBの配列・構造アライメント(Sequence and Structure Alignment)やPDBjのASHを使ってPDBに登録されているエントリーの配列や構造を比較することができます。例えば、ヘモグロビンのα鎖とβ鎖を比較し、どこが似ていてどこが違うのかを確かめてみてください。
- RCSB PDBのProtein Feature Viewにはある特定のタンパク質を別の生物で見つけるための便利な機能を備えています。例えば、ミオグロビンのProtein Feature Viewページをみて、画像の横にある小さな青い四角を探してみてください。
参考文献
- 2013 Gene duplication, genome duplication, and the functional diversification of vertebrate globins. Molecular Phylogenetics and Evolution 66 469-478
- 2012 Structures of haemoglobin from whooly mammoth in liganded and unliganded states. Acta Crystallographica D68 1441-1449
- 2nrl 2007 S-nitrosylation-induced conformation change in blackfin tuna myoglobin. Journal of Biological Chemistry 282 19773-19780
- 1ut0 2004 Crystal structure of cytoglobin: the fourth globin type discovered in man displays heme hexa-coordination. Journal of Molecular Biology 336 917-927
- 1shr 2004 Crystal structures of HbA2 and HbE and modeling of hemoglobin delta4: interpretation of the thermal stability and the antisickling effect of HbA2 and identification of the ferrocyanide binding site in Hb. Biochemistry 43 12477-12488
- 1oj6 2003 Human brain neuroglobin structure reveals a distinct mode of controlling oxygen affinity. Structure 11 1087-1095
- 1i3d 2001 Oligomerization and ligand binding in a homotetrameric hemoglobin: two high-resolution crystal structures of hemoglobin Bart’s (gamma(4)), a marker for alpha-thalassemia. Protein Science 10 1739-1749
- 1a9w 1998 Crystal structure of a human embryonic haemoglobin: the carbonmonoxy form of gower II (alpha2 epsilon2) haemoglobin at 2.9 A resolution. Journal of Molecular Biology 280 475-484
- 1lhs 1995 Reptile heme protein structure: X-ray crystallographic study of the aquo-met and cyano-met derivatives of the loggerhead sea turtle (Caretta caretta) myoglobin at 2.0 A resolution. Journal of Molecular Biology 247 459-465
- 1ymb 1990 High resolution study of the three-dimensional structure of horse heart metmyoglobin. Journal of Molecular Biology 213 885-897
- 3rgk 1990 X-ray crystal structure of a recombinant human myoglobin mutant at 2.8 A resolution. Journal of Molecular Biology 20 215-218
- 2hhb 1984 The crystal structure of human deoxyhaemoglobin at 1.74 A resolution. Journal of Molecular Biology 175 159-174
- 1mbo 1980 Structure and refinement of oxymyoglobin at 1.6 A resolution. Journal of Molecular Biology 142 531-554
- 1fdh 1977 Structure of human foetal deoxyhaemoglobin. Journal of Molecular Biology 112 97-112
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









