193: シデロカリン(Siderocalin)
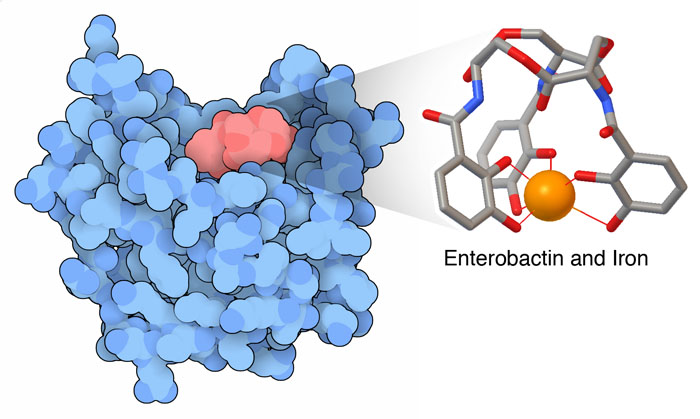
人類は昔から細菌による攻撃を受け続けている。私たちのはるか昔の祖先はこれに反撃するため、保護に関わる様々な分子を進化させてきた。これらの多くは最もよくある敵と戦うことに特化し、私たちの自然免疫系(innate immune system)を構成している。その多くは細菌の細胞壁にある弱点を攻撃する。例えばリゾチーム(lysozyme)はペプチドグリカン(peptidoglycan)でできた保護被膜を分解し、ダームシジン(dermcidin)は細胞膜を切り刻む。一方、シデロカリン(siderocalin)は全く別の弱点を攻撃する。細菌が鉄を必要とする点を突くのである。
強靭な体をつくるための鉄
鉄は環境中に豊富に存在するが、細胞で利用しづらい形であることが多く、可溶性鉄イオンの形で存在することは比較的少ない。私たちは鉄分の大半を食べ物から得ているが、肉や野菜のタンパク質には鉄分が使いやすい形であらかじめ梱包されている。一方、細菌のような遊離生活を送る生物は、鉄を見つけるとそれをかき集めつかみ取る必要がある。多くの細菌はシデロフォア(siderophore)と呼ばれる、鉄イオンの周囲を強固に取り囲む分子を作っている。細菌はシデロフォアを周辺環境に放出し、放出されたシデロフォアはそこで微少な鉄イオンを探す。その後シデロフォアを回収し、そこから貴重な鉄をほじくり出す。
飢えている細菌
私たちの自然免疫は、細菌がシデロフォアを見つけるよりも前にシデロフォアを隔離してこの過程を阻害する。私たちはシデロカリンと呼ばれるタンパク質を作っている。これには構造生物学者から
細菌の反撃
もちろん細菌集団は常に進化を続けていて、シデロカリンによる私たちの防御を回避する方法を見出したが出現している。鉄を集める能力は維持しているがシデロカリンとは結合しない、新たな「ステルス型」のシデロフォアを作ってこれを実現している。炭疽菌が作るステルス型シデロフォアはその一例である。 驚くべきことに、ライム病(Lyme disease) を引き起こす細菌はもっと思い切った方法を使っていて、鉄を全く必要としないプロテオーム(proteome)を作るようになっている。
鉄戦争 Iron Wars
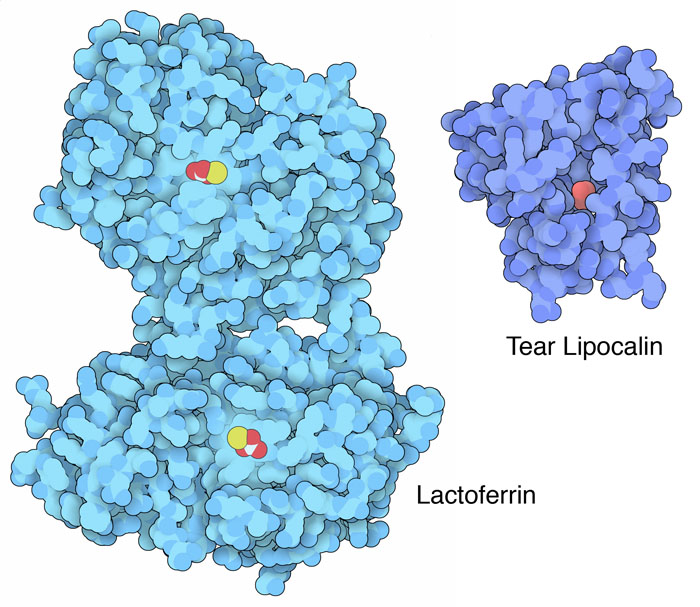
鉄を得るための戦いは大変重要なので、私たちもその戦いに参戦する別のタンパク質を進化させてきた。ここにそういったタンパク質を2つ示す。ラクトフェリン(lactoferrin、PDBエントリー1lfg)は、遊離鉄イオンの濃度を非常に低く抑え細菌が鉄を見つけられないようにするという別の方法をとっている。このタンパク質には鉄イオンと炭酸イオンがそれぞれ2分子ずつ結合している。これは私たちの血液中で鉄を輸送するトランスフェリン(transferrin)と似ている。ラクトフェリンという名前が示すように牛乳や分泌された体液などでみられるが、感染を受けた時に全ての鉄を吸い込むため白血球からも分泌される。涙液リポカリン(tear lipocalin、PDBエントリー3eyc)はリゾチーム(lysozyme)に次いで2番目に多く涙に含まれるタンパク質で、シデロフォアなどの分子に結合することも含め様々な防御に関わる役割を果たしている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
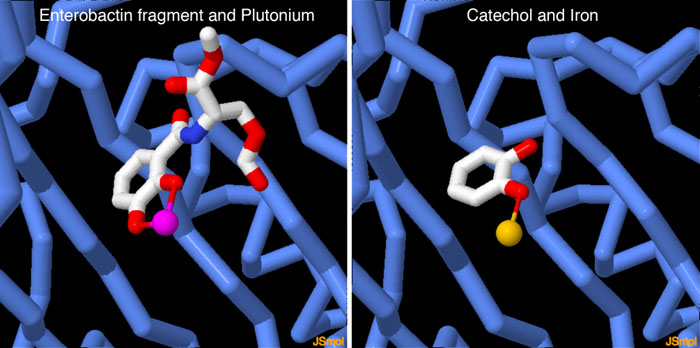
構造生物学者はシデロカリンを使った興味深い妙案を発見した。最近解かれたPDBエントリー4zhdはプルトニウム(plutonium)に結合していて、体内にある有毒な放射性イオンを運び出す役割をするかもしれないことが明らかになった。また、私たちの体内で天然に作られ細胞内での鉄イオン輸送を助けている内在性シデロフォアの探索も行われている。PDBエントリー3fw4には、その候補の一つで鉄イオンに結合するカテコール(catechol)が含まれている。図の下にあるボタンをクリックして対話的操作のできる画像に切り替え、これらの構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
- シデロカリンは、たくさんの種類があり、コップ型の分子結合部位を持つリポカリン類の一つです。リポカリンで検索すると、他のリポカリン類タンパク質を見ることができます。
- 鉄は細胞内で様々な機能を実現するために使われます。例えば、ヘモグロビンにおける酸素輸送や、電子伝達系のタンパク質における電子輸送などが挙げられます。詳細検索で化学式に「FE」を含むエントリーを検索すると、鉄を含むPDBエントリーの一覧を得ることができます。
参考文献
- 4zhd 2015 Siderocalin-mediated recognition, sensitization, and cellular uptake of actinides. Proceedings of the National Academy of Science USA 112 10342-10347 DOI:10.1073/pnas.1508902112 PMID:26240330 PMC:PMC4547258
- 2013 Siderocalins: siderophore binding proteins evolved for primary pathogen host defenses. Current Opinion in Chemical Biology 17 150-157 DOI:10.1016/j.cbpa.2012.11.014 PMID:23265976 PMC:PMC3634885
- 2012 Mammalian siderophores, siderophore-binding lipocalins, and the labile iron pool. Journal of Biological Chemistry 287 13524-13531 DOI:10.1074/jbc.R111.311829 PMID:22389496 PMC:PMC3340207
- 3fw4 2010 Iron traffics in circulation bound to a siderocalin (Ngal)-catechol complex. Nature Chemical Biology 6 602-609 DOI:10.1038/nchembio.402 PMID:20581821 PMC:PMC2907470
- 3eyc 2009 A new crystal form of human tear lipocalin reveals high flexibility in the loop region and induced fit in the ligand cavity. Acta Crystallographica Section D 65 1118-1125 DOI:10.1107/S0907444909031011 PMID:19770509 PMC:PMC2756164
- 1lfg 1995 Structure of human diferric lactoferrin refined at 2.2 A resolution. Acta Crystallographica Section D 51 629-646 DOI:10.1107/S0907444994013521 PMID:15299793
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









