162: ダームシジン(Dermcidin)
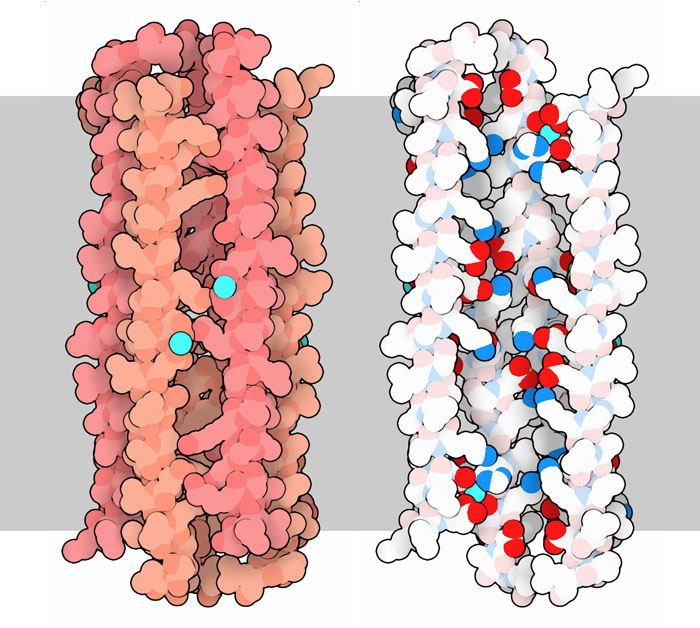
細菌は常に脅威となる存在であるため、私たちの身体は感染から身を守るための様々な防衛機構を備えている。最初の防衛線となるものの一つに抗菌ペプチド(antimicrobial peptide)と呼ばれる一連の小分子ペプチドがあり、私たちの細胞はこの抗菌ペプチドを分泌している。これらペプチドは多くの細菌種にとって有毒なもので、細菌の膜に結合し細菌の機能を妨げる。例えば、汗腺(sweat gland)から分泌される抗菌ペプチドの一種ダームシジン(dermcidin)は、皮膚にいる細菌を攻撃する。このペプチドの活性型はアミノ酸47個の長さがある。結晶構造(ここに示すのはPDBエントリー 2ymk)から分かるように、長いαらせんの形に折りたたまれ、それが6つ集まって筒状の構造を作り、細菌の膜に穴を開ける。そうなると大量のイオンが細胞膜を越えて細菌の細胞内に流れ込み、最終的には細菌を殺すことになる。
2つの顔
ダームシジンの機能を実現するための鍵は、らせんの中に配置されたアミノ酸にある。らせんは両親媒性(amphipathic)で、らせんの両側で異なる化学的性質を持っている。一方の側には電荷を持ったアミノ酸(上図右側に示す明るい赤と青で示した部分、内部を見やすくするため手前の鎖2本を取り除いて表示している)がたくさんあり、もう一方の側は炭素の豊富なアミノ酸(白い部分)でほとんどが占められている。この構造は膜を貫通する穴を開けるのに打って付けである。炭素が豊富なアミノ酸は全て外側に向いて並び、膜と相互作用する。一方電荷を持ったアミノ酸は内側の穴に沿って並び、イオンや水が膜を通り抜けるのに適したトンネルを作っている。
どうやって細菌だけを区別するのか?
もちろん、膜に穴を開けるペプチドは私たちの細胞にとっても危険な存在となり得る。そのため、抗菌ペプチドは細菌にしか存在しないものを対象にしておく必要がある。ここで抗菌ペプチドが利用するのは、私たちの細胞の膜と細菌の膜との違いである。細菌の膜には通常多くのリン脂質(phospholipid)が含まれ負電荷を持っているが、私たちの細胞の膜はほとんど中性である。ほとんどの抗菌ペプチドは強い正電荷を持っているので、細菌の膜に結合しやすくなっている。しかし奇妙なことに、ダームシジン全体としては負電荷を帯びているので、汗に豊富に含まれる亜鉛を利用して細菌の膜にある脂質と特有の相互作用を作れるようにしている。
抗菌ペプチド
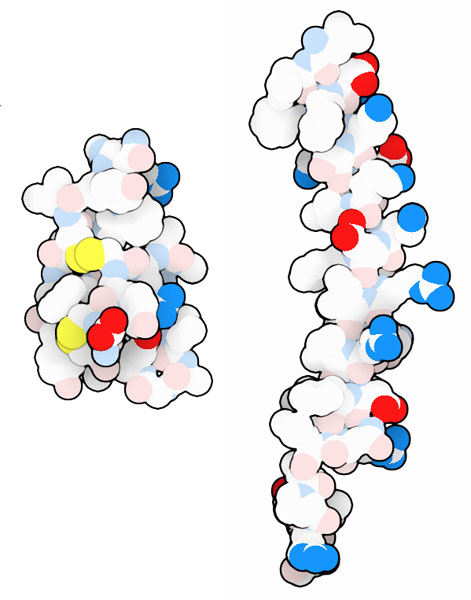
この小さなペプチドは大変効果的なので、様々な種類の生物が利用している。形や大きさは様々だが、細菌の膜に穴を開けられるようにする両親媒性の構造は共通している。ヒトの抗菌ペプチドの例を2つここに示す。左の分子はディフェンシン(defensin、PDBエントリー 1dfn)で、3つのジスルフィド結合(disulfide linkage/bond)によってつなぎ止められ、強固に折り畳まれた球状の構造を作っている。この構造は、抗菌ペプチドが細菌の持つタンパク質分解酵素によって破壊されることのないよう保護するのに役立っている。右の分子はLL-37(PDBエントリー 2k6o)で、ダームシジンと似たαらせんを作る。他にも多くの例がPDBに登録されている。
構造をみる
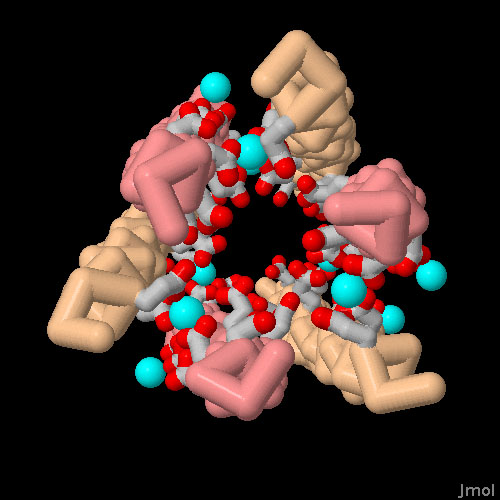
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
ダームシジンの構造(PDBエントリー 2ymk)は、どのようにして亜鉛イオン(zinc ion)が膜に穴を開けるのを助けているかを示している。亜鉛イオンは隣接する負電荷を帯びたアミノ酸の間をつないで複合体全体をまとめている。画像下のボタンをクリックして対話的操作のできる画像に切り替えるとこの相互作用をより詳しくみることができる。
理解を深めるためのトピックス
参考文献
- 2011 Designing antimicrobial peptides: form follows function. Nature Reviews Drug Discovery 11 37-51
- 2011 Defensins in innate immunity. Cell Tissue Research 343 175-188
- 2006 The co-evolution of host cationic antimicrobial peptides and microbial resistance. Nature Reviews Microbiology 4 529-536
- 2003 Defensins: antimicrobial peptides of innate immunity. Nature Reviews Immunology 3 710-720
- 2002 Antimicrobial peptides of multicellular organisms. Nature 415 389-395
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









