140: ロンボイドプロテアーゼGlpG(Rhomboid Protease GlpG)
タンパク質鎖を切断する酵素であるプロテアーゼ(protease)には様々な形や大きさのものがある。最も馴染みのあるトリプシン(trypsin)やペプシン(pepsin)のようなプロテアーゼは食物中に含まれるタンパク質の消化に用いられるタンパク質破壊機構である。ところが、私たちの細胞内にあるプロテアーゼのほとんどはもっと繊細な仕事に使われている。このようなプロテアーゼは、他のタンパク質の特定箇所を切断することによりそのタンパク質の活動を制御する。切断されると活性化するタンパク質もあれば、永久的に破壊されてしまうタンパク質もある。どちらの場合も、変化は素早くて永続的なものであり、これによって対象となるタンパク質の働きをONにしたりOFFにしたりしている。
プロテアーゼが膜の中に?
長年、プロテアーゼは小さな可溶性の酵素であると見られていた。その理由は主として、消化に使われるプロテアーゼが、豊富にあって研究しやすかったことによる。ところが現在では、小さくて安定した消化酵素から要らなくなった細胞内のタンパク質を除去する巨大なプロテアソーム(proteasome)まで様々な形や大きさのものがあることが知られている。そしてここ10年程度の間に全く新しい型のプロテアーゼが発見されてきている。それは膜の中で他の膜タンパク質を切断するプロテアーゼである。
ロンボイドプロテアーゼ
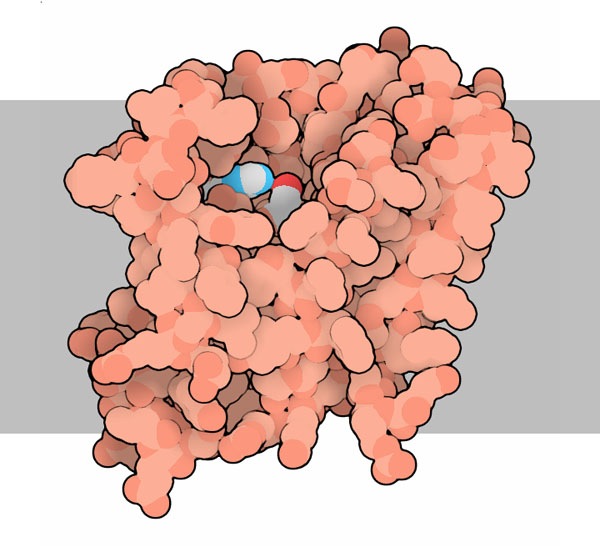
最初の膜内セリンプロテアーゼ(intramembrane serine protease)は変異体ショウジョウバエから発見され、その奇妙な形をした頭から「ロンボイド」(rhomboid、偏菱形、長斜方形、隣接辺・隣接角が等しくない平行四辺形のこと)と名付けられた。このプロテアーゼは頭の形を制御する成長受容体を調節しているので、ショウジョウバエの変異体にちなみ現在ではロンボイドプロテアーゼ(rhomboid protease)と呼ばれている。皮肉にも、このプロテアーゼ自身も見る角度によっては菱形に近い形で、細胞膜内に浮かんでいる。ここに示したのは細菌のロンボイドプロテアーゼ「GlpG」で、PDBエントリー 2ic8、2irv、2nrfなどで見ることができる(ここに示したのは2nrf)。
活性部位の機構
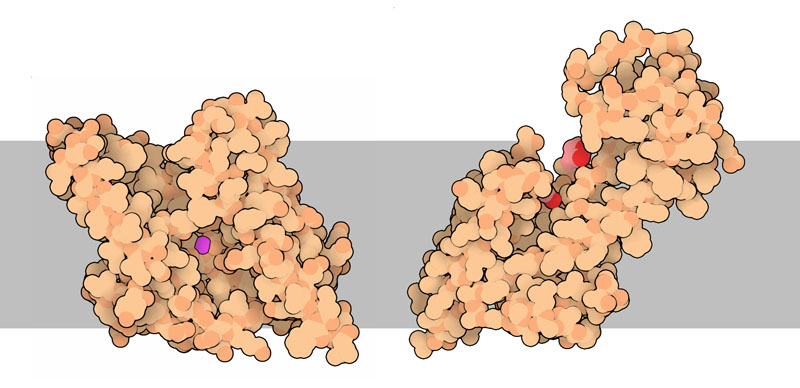
別の型の膜内プロテアーゼも発見されているが、これらは可溶性プロテアーゼでよく見られる触媒機構を多く用いる。ロンボイドプロテアーゼは、セリン(serine)とヒスチジン(histidine)から成る一組の高反応性アミノ酸を使う。これはトリプシン(trypsin)やキモトリプシン(chymotrypsin)のようなセリンプロテアーゼの活性部位と似ている。ここに示した細菌由来のプロテアーゼ(PDBエントリー 3b4r)のようなサイト2(site-2)ファミリーのプロテアーゼは亜鉛イオン(zinc ion)を使うが、これはカルボキシペプチダーゼ(carboxypeptidase)のような可溶性の金属タンパク質分解酵素(metalloproteinase)に似ている。更に、上図右に示した「フラジェリン前駆体ペプチド分解酵素FlaK」(preflagellin peptidase FlaK、PDBエントリー 3s0x)や、アルツハイマー病の発達に重要な役割を果たす巨大なペプチド分解酵素複合体「γセクレターゼ」(gamma-secretase)のような酸プロテアーゼも膜内に見つかっている。
構造をみる
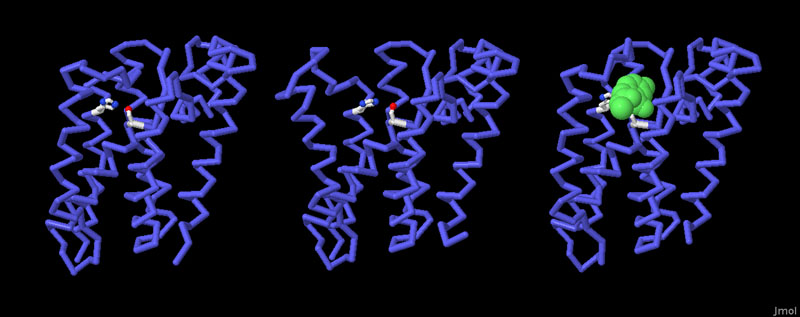
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
膜内プロテアーゼは扱いが難しい仕事を行っている。この酵素は疎水的な膜内で無理なく存在できる必要がある一方、水や水と結合するアミノ酸を使って反応を行う必要もある。この相反する要求は、活性部位を覆う柔軟な環状領域を持ち、対象分子と水の両方に接近することができるようにすることで実現している。3つの構造によってこの柔軟性についてある程度の部分が明らかになった。但し、膜タンパク質の研究には膜外にあるタンパク質を安定化させる人工的な方法を使う必要があるため、まだ議論のある点が多く残っている。上図左(PDBエントリー 2ic8)はきちっと閉じた構造、中央(2nrf)は大きく開いた構造である。また上図右(2xow)は阻害剤を取り囲んで閉じた構造を示している。なお、図の下のボタンをクリックすると、対話的操作のできる画像に切り替え、構造を比較することができる。
理解を深めるためのトピックス
- PDBエントリー 3b4r には同じタンパク質が2つ含まれていて、一方は閉じた構造、もう一方は開いた構造になっている。RCSB PDBのStructure Comparisonなどを使えばこの2つの型を比較することができる。
- 通常、膜タンパク質の外側には疎水性のアミノ酸があり、これが周囲の膜と相互作用する。その様子を見るには、ロンボイドプロテアーゼやその他の膜結合性タンパク質の個別エントリーページにアクセスし、3D表示で表示スタイルを「CPK」(各原子を球で表示)、配色を「hydrophobicity」(疎水度に応じた配色)にしてみるといいだろう。
参考文献
- 2009 Structure and mechanism of intramembrane protease. Seminars in Cell & Developmental Biology 20 240-250
- 2008 Rhomboid proteases and their biological functions. Annual Review of Genetics 42 191-210
- 2008 Core principles of intramembrane proteolysis: comparison of rhomboid and site-2 family proteases. Current Opinion in Structural Biology 18 432-441
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









