94: スーパーオキシドジスムターゼ(Superoxide Dismutase)
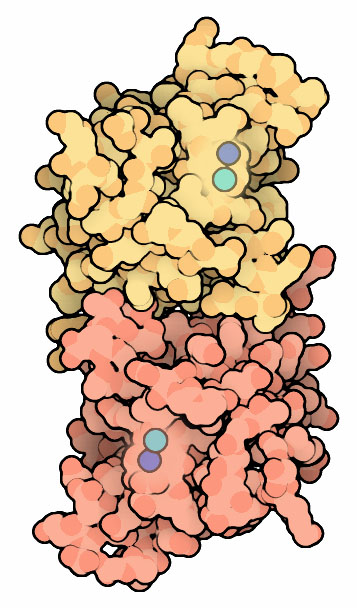
私たちは酸素なしで生きていくことはできない。各細胞は、呼吸において電子の最終受容体として酸素に依存しており、酸素がない場合に比べてずっと多くのエネルギーを食物から得ることができる。ところが酸素は危険な化合物でもある。超酸化物(過剰に電子を持つ酸素)などの反応性酸素は、呼吸酵素から漏れ出し、細胞をむちゃくちゃに壊してしまう。この超酸化物はDNA変異の原因となり、またアミノ酸などの必須分子を作る酵素を攻撃する。これは重大な問題であり、ある研究によると大腸菌の細胞において呼吸経路を輸送される電子10000個中3個が適切な場所に行かず、超酸化物のところに行ってしまう。この潜在的な危険と戦うため、多くの細胞は超酸化物不均化酵素(SuperOxide Dismutase (SOD)、ここに示したのはPDBエントリー 2sodのもの)を作る。この酵素は超酸化物を無毒化する酵素である。
不均化
超酸化物不均化酵素(SOD)はその名前から想像がつくように、超酸化物を不均化する。不均化とは一つの特殊な型の反応を指す言葉で、同じだが逆方向の反応を2つの分子に起こす。SODは2つの超酸化物分子に作用し、一方から余分な電子をはぎとり、もう一方に与える。その結果、一方は電子が減少して通常の酸素になり、もう一方は過剰な電子を持つ。そして、後者は素早く2つの水素イオンを取り込み水素過酸化物を形成する。もちろん水素過酸化物も危険な化合物ではあるが、各細胞はカタラーゼ酵素を使って無毒化することだろう。
臨床におけるSOD
SODは最近、筋萎縮性側索硬化症(amyotrophic lateral sclerosis、ALS、ルー・ゲーリッグ病 Lou Gehrig's disease とも呼ばれる)と関係していることで悪名高くなっている。この病気は、脳と背骨の腱にある神経細胞が選択的に死んでいき、数年かけて麻痺が徐々に進行する変性疾患で、多くの場合、不思議なことに人生の終わりの方で原因が分からず発症する。但し、約10分の1は遺伝性で、親から遺伝した変異によって引き起こされる。最近の研究によって、その変異の一つはSOD遺伝子にあることが明らかになった。現在、科学者たちはこの病気におけるSODの役割を研究しており、これが明らかになれば新たな診療と治療につながると期待されている。
重金属
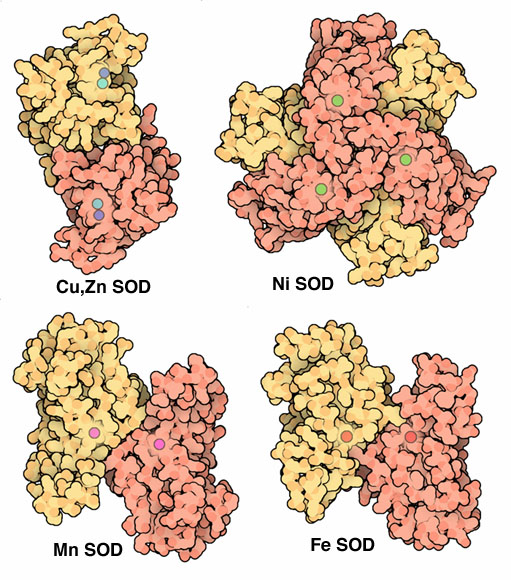
全ての生物は、いずれかの型のSODを持っているようだが、その超酸化物の処理方法にはいくつかのパターンがある。上図に示した酵素は、それぞれ異なる金属イオンを利用して電子転移反応を行っている。私たちの細胞では3種類のSODが作られている。銅・亜鉛SOD(上図左上、PDBエントリー 1sos)は細胞内をただよってあらゆる超酸化物を一掃してくれる。そしてこれに似たものが、粘着性の尾部で作られ、これがSODを細胞外の構造にくっつける。分かれたマンガンSOD(上図左下、PDBエントリー 1msd)は、私たちのミトコンドリアで使われている。細菌は異なる型のSOD酵素を作っており、それには鉄SOD(上図右下、PDBエントリー 3sdp)や、普通みられないニッケルを持つSOD(上図右上、PDBエントリー 1q0d)が含まれる。
構造を見る
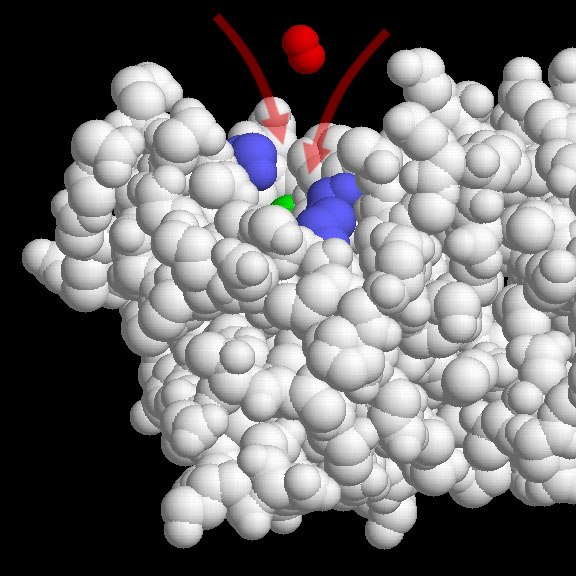
銅/亜鉛(Cu/Zn)超酸化物不均化酵素(PDBエントリー 2sod)は大変有能な酵素である。研究者は、超酸化物の酵素への衝突10回につき1回が反応することを突き止めた。これは予期していたよりもずっと多いものである、というのも、活性部位は酵素表面のごく一部しか占めていないからである。そこで、私たちはほとんどの衝突は表面以外の場所で起こっているのではないかと考えた。ところがこの活性部位の形と性質から、この能力に関するヒントが得られる。活性部位は、漏斗の形をしていて、基部には銅イオンと亜鉛イオン(緑色の球)がある。強く正電荷を帯びた金属イオンは、近くにある正電荷を帯びたアミノ酸(青色の球)に沿って存在し、負電荷を帯びた超酸化物(赤色の球)を漏斗の中で導き入れる役割をしている。
"Superoxide Dismutase" のキーワードでPDBエントリーを検索した結果はこちら。
超酸化物不均化酵素についてさらに知りたい方へ
以下の参考文献もご参照ください。
- P. Pasinelli and R. H. Brown (2006) Molecular biology of amyotrophic lateral sclerosis: insights from genetics. Nature Reviews Neuroscience 7
- J. A. Imlay and I. Fridovich (1991) Assay of metabolic superoxide production in Escherichia coli. Journal of Biological Chemistry 266
- I. Fridovich (1989) Superoxide dismutases. Journal of Biological Chemistry 264
- E. D. Getzoff, J. A. Tainer, P. K. Weiner, P. A. Kollman, J. S. Richardson and D. C. Richardson (1983) Electrostatic recognition between superoxide and copper, zinc superoxide dismutase. Nature 306
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









