57: カタラーゼ(Catalase)
生物にとって酸素は危険なものである。私たちは酸素に依存して細胞の動力を得ているが、酸素は反応性に富む分子で伸張に取り扱わないと重大な問題を引き起こしてしまう。酸素の持つ危険な性質の一つは、簡単に他の反応性に富む化合物に変えられてしまうことである。私たちの細胞の中では、電子輸送分子が電子をあちこち運び回っている。このような輸送分子は、リボフラビン(riboflavin)やナイアシン(niacin)から誘導される。もし酸素がこれらの輸送分子の1つに入り込むと、電子は偶然酸素の方に移動してしまうかもしれない。そうなると酸素は超酸化物ラジカルや過酸化水素などの危険な化合物に変わる。そして、タンパク質に含まれる硫黄や金属イオンなどの繊細な原子を攻撃する。また更にまずいことに、細胞内にある遊離鉄イオンは過酸化水素をヒドロキシルラジカルに変換してしまうことがある。このような致死的な分子はDNAを攻撃して変異を起こす。ある理論によると、まだ議論の余地があるものの、この種の酸化的損傷が年々積み重なることで、老化現象が起きている。
救出のための抗酸化物
幸いにして、細胞は様々な抗酸化酵素を持っていて、酸素が生命におよぼす危険な副作用に対抗している。この反応には2つの重要な酵素〜超酸化物ラジカルを過酸化水素に変換する「超酸化物不均化酵素」(今月の分子94番に掲載)と、過酸化水素を水と酸素ガスに変換する「カタラーゼ」〜が関わっている。これら酵素の重要性は広く存在することによって示されており、その存在割合は大腸菌タンパク質の約0.1%から感受性細胞型に含まれるタンパク質の4分の1まで幅がある。この多くのカタラーゼ分子は細胞内を巡視していて、過酸化水素の絶え間ない発生に対抗し安全な水準を保ち続けている。
より良く、より強く、より速く
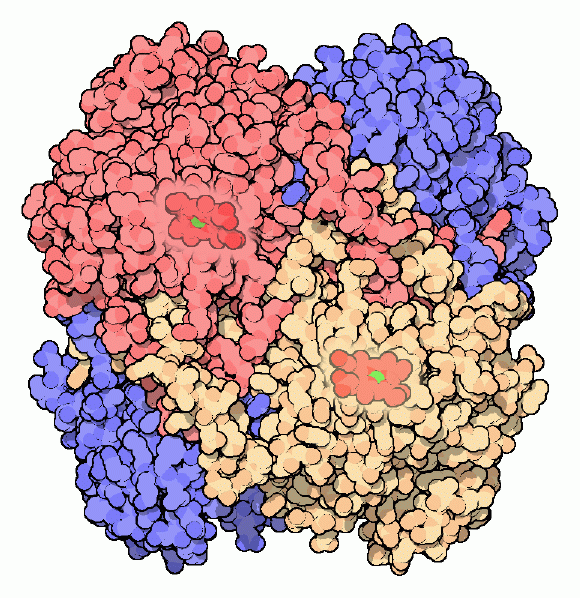
カタラーゼは細胞内で見られる最も効率的な酵素の一つである。それぞれのカタラーゼ分子は毎秒何百万個もの速さで過酸化水素を分解することができる。ここに示すウシのカタラーゼ(PDBエントリー 8cat)や、私たちが持つカタラーゼは鉄イオンの助けを借りてこの素早い反応を行っている。酵素は4つの同じサブユニットから構成されていて、各サブユニットは内側奥深い場所に活性部位を持っている。緑色で示す鉄イオンは円盤状のヘム基(heme group)の中心に捕えられている。カタラーゼは反応性の分子に対抗しなければならないので、一般的には見られない安定性を持つ酵素でもある。4つの鎖がどのように交わり、複合体全体を適切な形に閉じ込めているのかに注目して欲しい。
カタラーゼの種類
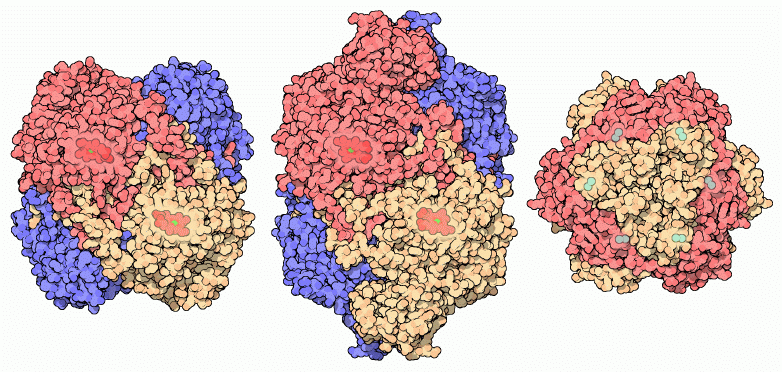
細胞の種類が違えば、そこでつくられるカタラーゼの種類も異なる。その多くはPDBに登録されており研究学習に利用することができる。上図左に示したのは、私たちの赤血球を保護するカタラーゼ(PDBエントリー 1qqw)で、4つの同じサブユニットで構成されており、反応にはヘム/鉄グループを利用する。一方多くの細菌は、私たちのものより大きなカタラーゼ(上図中央、PDBエントリー 1iph)を使って過酸化水素を取り除いている。このカタラーゼにおける鉄とヘムの配置は私たちのものと似ている。また、ヘムの代わりにマグネシウムイオンを使う全く違ったカタラーゼ(上図右、PDBエントリー 1jku)で自己防衛を行う細菌もいる。なお、欧州バイオインフォマティクス研究所(EBI)の「今月のタンパク質」(Protein of the Month)では、遺伝的視点から見た追加情報の提供を行っている。
構造をみる
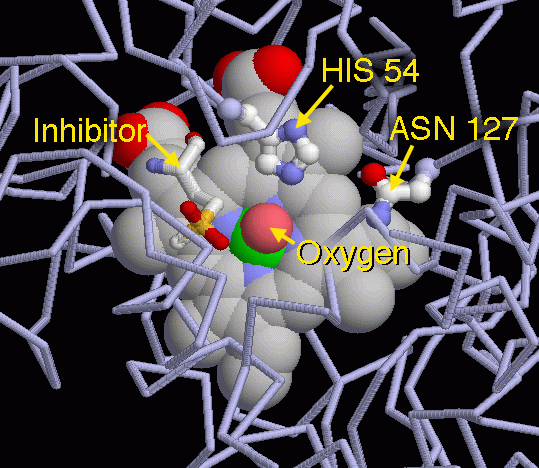
カタラーゼはその素早い過酸化水素分解反応を2段階で行っている。まず、過酸化水素分子をはカタラーゼに結合し、部分的に破壊される。1つの酸素原子が取り出されて鉄原子に付加され、残りが害のない水として放出される。次に、2つ目の過酸化水素分子がカタラーゼに結合する。また同じように部分的に破壊され、取り出された酸素原子が鉄に結合した酸素と結合し、水と酸素ガスが放出される。PDBエントリー 2cagは、この2つの反応段階の真ん中の状態を捕えたものである。酸素原子が鉄に結合し、2つ目の過酸化水素分子が結合する準備ができている状態である。アミノ酸のヒスチジンとアスパラギンが反応を助けていることがここでは示されている。左にある小さな分子は、この興味ある段階で酵素をとどまらせるために研究者が加えた阻害剤で、これによって観察に十分な時間が得られるようになった。
なお、これらの構造を見る時、適切な生物単位が取得できているかを確認してください。
"カタラーゼ" のキーワードでPDBエントリーを検索した結果はこちら。
カタラーゼについてさらに知りたい方へ
以下の参考文献もご参照ください。
- P. Chelikani, I. Fita and P. C. Loewen (2004) Diversity of structures and properties among catalases. Cellular and Molecular Life Sciences 61
- J. A. Imlay (2003) Pathways of oxidative damage. Annual Review of Microbiology 57
- P. Nicholls, I. Fita and P. C. Loewen (2001) Enzymology and structure of catalases. Advances in Inorganic Chemistry 51 51-106.
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









