30: グルタミン合成酵素(Glutamine Synthetase)
私たちの細胞は常に環境変化と直面している。あなたが食べるものを想像してみて欲しい。タンパク質を多く食べる日もあれば、炭水化物を多く食べる日もあるだろう。時にはチョコレートしか食べないこともあるかもしれない。身体はそれぞれの食べ物に含まれる栄養素を捕らえるための適切な酵素を作り、これら様々な食べ物に対応できなければならない。この点について、食べ物に関する選択の余地が私たちに比べて少ない細菌などの小さい生物ではより一層当てはまることだと言える。小さな生き物は偶然近づいてきた食べ物は何でも食べ、その食べたものを利用するのに必要な酵素を動員する必要がある。
分子のコンピュータ
グルタミン合成酵素は細胞内の窒素利用を制御する上で中心となる酵素である。 グルタミン(glutamine)はタンパク質を作るだけではなく、DNA塩基やアミノ酸のように窒素が多く含む分子を作る酵素に窒素原子を渡すのにも使われる。 そのため、グルタミンを作るグルタミン合成酵素は慎重に制御されなければならない。 窒素が必要な時は、酵素を活性化して細胞が飢えないようにする必要がある。 一方細胞に十分な窒素がある時は、供給過剰となるのを避けるため酵素を不活性化する必要がある。
グルタミン合成酵素は小さな分子コンピュータのように働き、窒素が豊富な分子の数を監視している。グリシン(glycine)、アラニン(alanine)、ヒスチジン(histidine)、トリプトファン(tryptophan)といったアミノ酸の濃度やAMP、CTPといったヌクレオチドの濃度を監視している。もしこれら窒素の豊富な分子のいずれか1種が作られ過ぎると、グルタミン合成酵素はそのことを検知し、産生速度を少し落とす。しかし、これらヌクレオチドやアミノ酸の濃度が全て高まると、これらの分子が一緒になってグルタミン合成酵素の活性をどんどん落としていく。そして最終的に供給が需要に追いつく時、酵素はゆっくり停止する。
多くの活性部位間でのやりとり
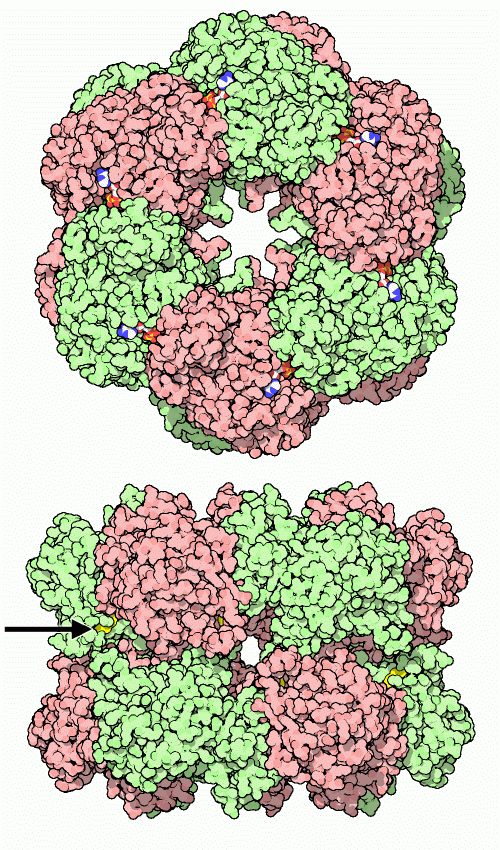
ここに示すグルタミン合成酵素分子(PDBエントリー 1fpy)は細菌から得られたものである。12個の同じサブユニットで構成され、それぞれがグルタミンを作るための活性部位を持っている。反応を行う際、活性部位はグルタミン酸(glutamate)とアンモニア(ammonia)に結合し、また反応の動力を供給するATP分子とも結合する。しかし、活性部位は他のアミノ酸やヌクレオチドとも弱く結合し、部分的に酵素の活性を阻害する。たくさんある活性部位は他の活性部位と通信しており、本来の基質と競合する分子の濃度が上昇すると、より多くの活性部位が阻害され、最終的に酵素全体の活性が停止してしまう。しかし細胞が自ら酵素を停止させたい時はより直接的な方法を使う。活性部位に隣接する重要なアミノ酸チロシン(tyrosine、黄色で示した分子、矢印をつけている)にADP分子をタンパク質に付加することで活性を完全に阻害できる。
制御の欠如
私たちは細胞内で何種類かのグルタミン合成酵素を作っている。私たちの細胞の大半はここに示した細菌のものと似た型のものを作るが、サブユニットの数は12ではなく8である。そして細菌と同じく、合成経路の後方は窒素豊富な化合物によって制御されている。ただ私たちは、脳では別の型のグルタミン合成酵素を作っている。脳ではグルタミン酸が神経伝達物質として用いられており、神経興奮が発生した後グルタミン酸を再利用する際グルタミン合成酵素が使われている。脳内ではグルタミン合成酵素が常に活動しているので、高度に調節された酵素を使うのは適切ではない。代わりにもう一つの型のグルタミン合成酵素が常に活性状態になっていて、継続的に不可欠な仕事を行っている。
2つの扉
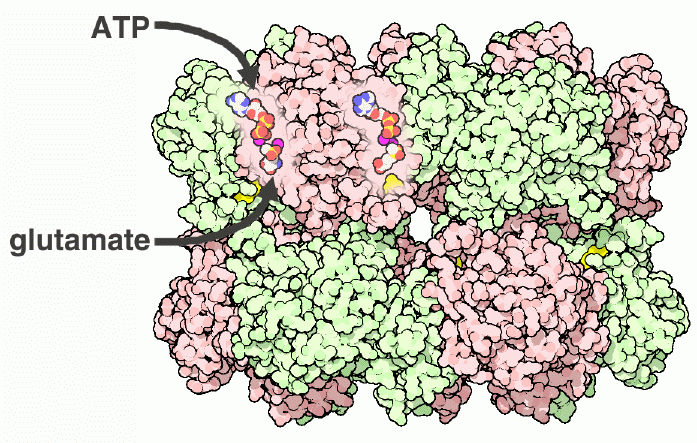
グルタミン合成酵素のサブユニット12個は、それぞれの活性部位となるトンネルの中央に2個ずつ金属イオン(マグネシウム magnesium またはマンガン manganese、赤紫色の部分)が結合している。基質はトンネルの両側から入る。ATPは酵素の外部に面した上下の面から入る(ATPは冒頭の上側の図を見ればその存在がすぐ分かるだろう)。グルタミン酸とアンモニアは上6つのサブユニットが作る輪と下6つのサブユニットが作る輪の間から押し込まれる。ここに示す構造(PDBエントリー 1fpy)にはATP結合部位に結合したADP、2個のマンガンイオン(マグネシウムよりも強固に結合するが酵素の動きを少し遅らせる)、そしてグルタミンとほぼ同じ大きさと形も持つ阻害剤が含まれている。
構造をみる
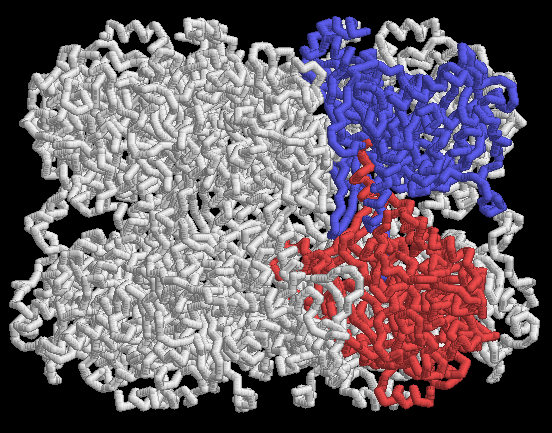
グルタミン合成酵素は巨大な酵素である。この酵素の構造を見る際、PDBエントリー 2gls が最初に見るのに適した構造の一例と言えるだろう。ここに示すように主鎖表現で表示して、各サブユニット間の相互作用を見てみて欲しい。グルタミン合成酵素の制御はサブユニット間のやりとりに依存しているため、各サブユニットは強固に束ねられ一緒にされた状態になっている。各鎖の末端は反対側の環に属する隣接サブユニットの真ん中へと伸びている。赤のサブユニットがどのようにして青のサブユニットの中へ入り込んでいるのかに注目して欲しい。
"グルタミン合成酵素" のキーワードでPDBエントリーを検索した結果はこちらで参照できます。
更に知りたい方へ
以下の参考文献もご参照ください。
- 2000 Structure-function relationships of glutamine synthetases. Biochimica et Biophysica Acta 1477 122-145
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









