306: 東部馬脳炎ウイルス(Eastern Equine Encephalitis Virus)
東部馬脳炎ウイルス(Eastern Equine Encephalitis Virus、EEEV)とその近縁種である西部馬脳炎ウイルス(Western Equine Encephalitis Virus、WEEV)やベネズエラ馬脳炎ウイルス(Venezuelan Equine Encephalitis Virus、VEEV)は、哺乳類に脳の腫れ(脳炎)や関節の腫れ、麻痺、その他の神経症状を引き起こすウイルスである。さまざまな馬脳炎ウイルスはすべて人獣共通感染症であり、動物と人間の間で感染する可能性がある。EEEVは馬や家畜の健康に有害な影響を与えることから名付けられたが、主にコマドリやスズメなどの一般的に目にする種を含むスズメ類の間で流行している。ほとんどの鳥類において、EEEVは症状は引き起こさずに増殖することができる。感染した鳥の血を吸う蚊は、ヒトを含む哺乳類の宿主にウイルスを感染させる可能性がある。人に感染してもほとんど気づかれないが、約5%の人に症状が現れる。
構造タンパク質
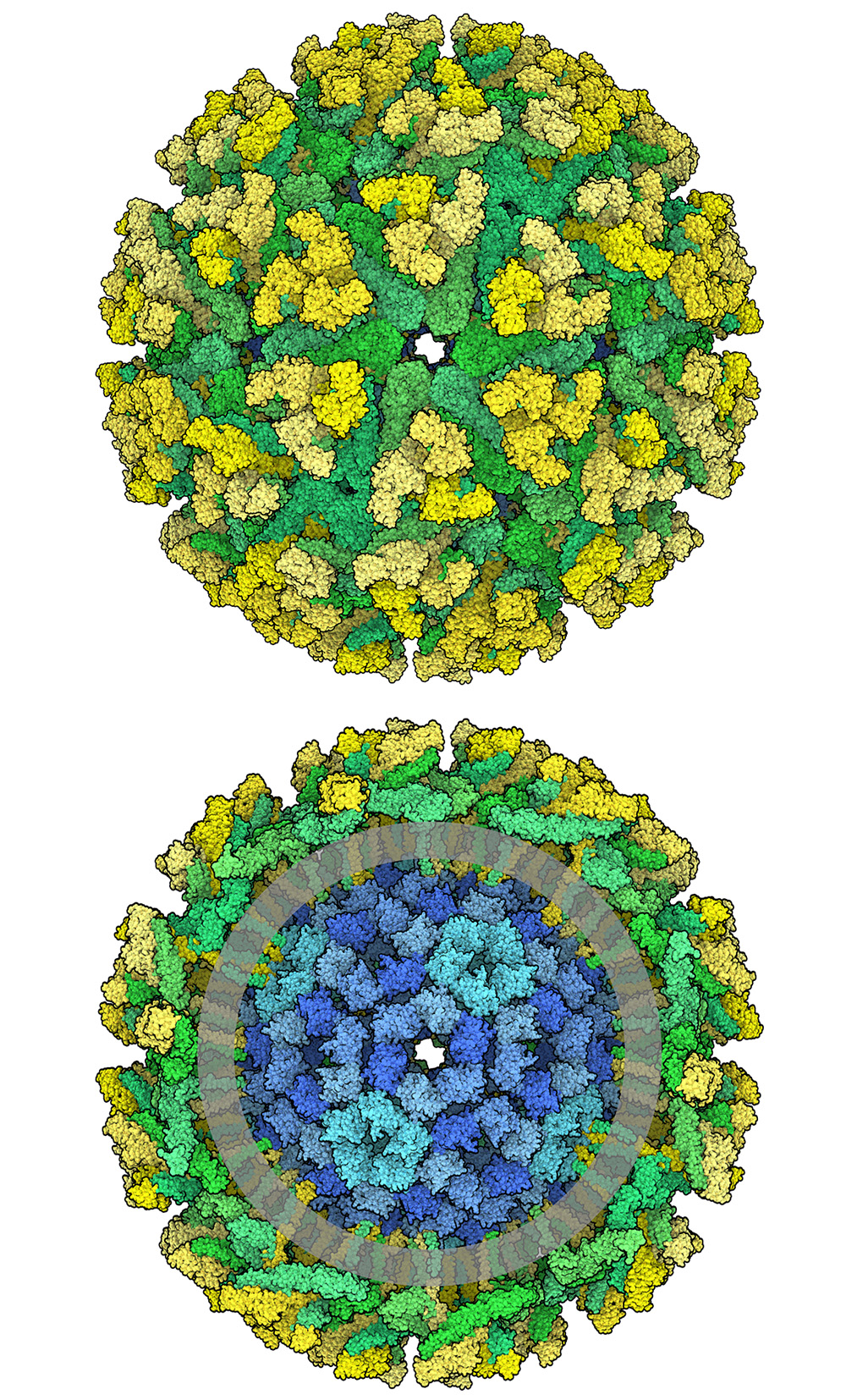
EEEVはトガウイルス科(Togaviridae)アルファウイルス属(Alphavirus)に属する小型のウイルスで、一本鎖RNAゲノムを持ち膜(エンベロープ)で包まれている。ウイルス表面には、E1(右図では緑色で示す、6MX4)とE2(黄色で示す)と呼ばれる240個の膜貫通型エンベロープ糖タンパク質が規則正しく格子状に密集し、3量体のスパイクをつくっている。膜の内側では、さらに240個のカプシドタンパク質(断面図では青色で示す)が、RNAゲノムを詰め込み保護することを助けている。EEEVには、E1、E2、カプシドの他に、6KとTFという2つの構造タンパク質が含まれており、これらは感染において重要な役割を果たすが、図には示していない。
EEEVのようなアルファウイルスによる細胞への感染は、ウイルス表面にある糖タンパク質と細胞表面にある膜タンパク質との接着相互作用に依存している。EEEVは、細胞に付着した後エンドサイトーシスによって細胞内に取り込まれる。エンドソームの酸性環境は、エンベロープタンパク質に一連の構造変化を引き起こし、その結果、ウイルス膜とエンドソーム膜が融合し、それによってカプシドはゲノムとともに細胞質に放出される。カプシドが分解されると、ウイルスのプラス鎖RNAが放出され、リボソームによって直接読み取られ、ウイルスタンパク質の生産につながる。
さまざまな方法をつかった付着
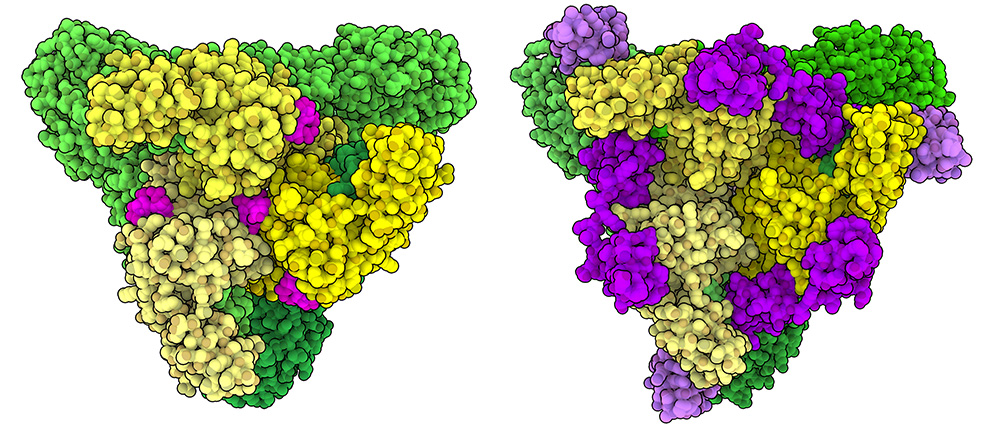
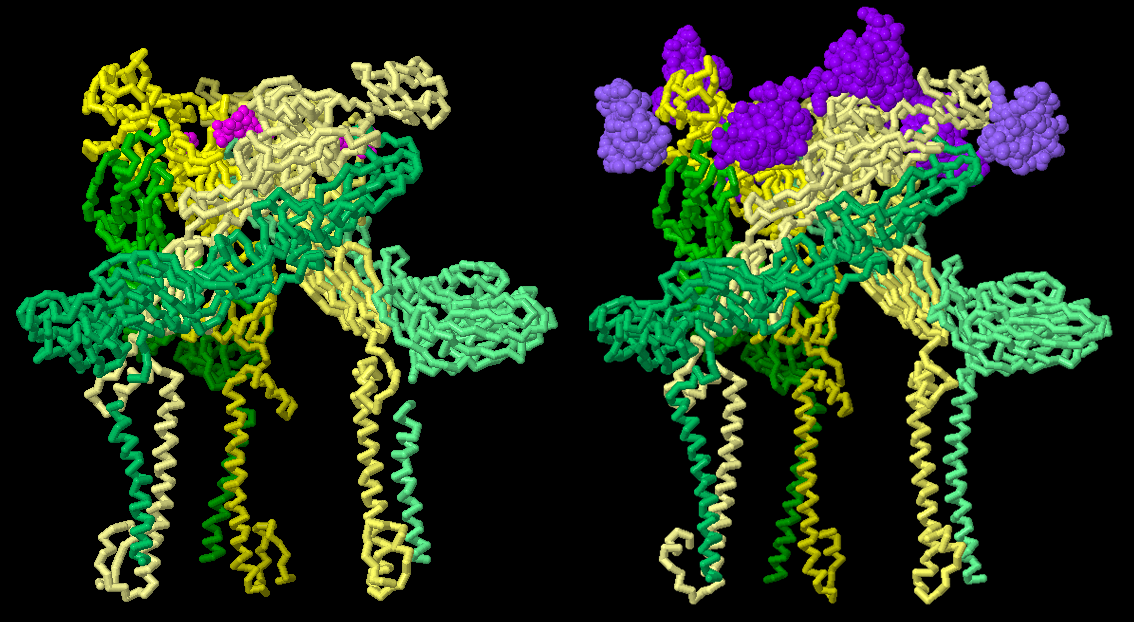
EEEVを非常に危険なものにしている特徴のひとつは、鳥、昆虫、哺乳類を含むさまざまな生物においていろいろなタイプの細胞に感染する能力を持っていることである。異なる宿主に適応するこの能力があるのは、EEEVが細胞表面の受容体に結合する方法が一つの理由になっていると考えられている。HIVのように、主に特定の細胞表面タンパク質に結合するウイルスもあるが、EEEVは、超低密度リポタンパク質受容体(very low density lipoprotein receptor、VLDLR)、アポリポタンパク質E受容体2(apolipoprotein E receptor 2、ApoER2、LRP8とも呼ばれる)、細胞表面タンパク質を一般的に装飾する糖であるヘパラン硫酸(heparan sulfate)など、いくつかの異なる分子に結合できることが示されている。EEEVエンベロープタンパク質とヘパラン硫酸(ピンク色、6ODF)およびVLDLR(紫色、8UFC)とのの結合を示した構造を左図に示す。長く柔軟な細胞外ドメインを持つVLDLRが、さまざまな方法でEEEVエンベロープタンパク質と結合できることが発見されている。EEEVによる宿主細胞への付着とその後の感染は、単一の強い接触に依存するのではなく、ウイルスと細胞表面分子との間に形成される複数の弱い相互作用を必要とするようである。この戦略により、EEEVは多様な宿主に容易に適応することができるのかもしれない。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
ヘパラン硫酸(6ODF)やVLDL受容体(8UFC)を含むさまざまな細胞表面分子が、EEEVのエンベロープタンパク質とどのように結合するかを見てみて欲しい。
理解を深めるためのトピックス
- EEEVをはじめとするアルファウイルスは、T=4対称性を示す正20面体ウイルスである。詳しくは準対称性を参照して欲しい。
参考文献
- 6MX4 2018 Dec 11 Cryo-EM Structures of Eastern Equine Encephalitis Virus Reveal Mechanisms of Virus Disassembly and Antibody Neutralization. Cell Rep. 25 11 3136-3147
- 6ODF 2020 Apr 21 Cryo-EM structure of eastern equine encephalitis virus in complex with heparan sulfate analogues. Proc Natl Acad Sci U S A. 117 16 8890-8899
- 8UFC 2024 Jan 18 Structural and functional basis of VLDLR usage by Eastern equine encephalitis virus. Cell 187 2 360-374
- 2022 Feb VLDLR and ApoER2 are receptors for multiple alphaviruses. Nature 602 7897 475-480
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト