27: バクテリオロドプシン(Bacteriorhodopsin)
日光は生物の世界にエネルギーを供給している。光合成(photosynthesis)を通じて植物は日光を捕らえ糖を作っている。私たちの成長とエネルギー需要のための開始物質は全てこの糖によってまかなわれている。昨年10月の今月の分子(光化学系I)で紹介したように、光合成には複雑な分子のアンテナと光合成機構の集まりを必要とする。ところがある古細菌は日光を捕らえる簡単な方法を見つけた。
光で動くポンプ
バクテリオロドプシン(bacteriorhodopsin)は水素イオン(プロトン、proton)を膜を越えてくみ出す小型の分子機械で、緑の日光によって推進される。これは高温の塩湖で見られる好塩性古細菌(halophilic archaea)によって作られるものである。日光を使って水素イオンを細胞膜の外側へとくみ出し、細胞の内側を外側の1万倍強いアルカリ性にしている。このくみ出された水素イオンは別のタンパク質を通して細胞内へと流れ戻り、その際ATPが合成される。これにより細胞を動かすATPの大半が作られる。
光を捕らえる
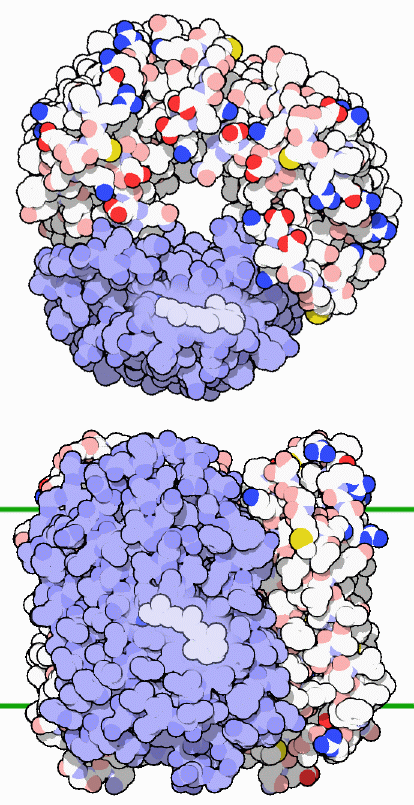
ここに示したバクテリオロドプシン(PDBエントリー 1fbb)は3つのタンパク質鎖で構成されている。これは細菌の膜に密集して多数埋め込まれている。膜をまたぐ部分が下の図に示されている(2本の緑の線ではさまれた部分)。各タンパク質鎖の中心にあるのはレチナール(retinal)分子で、タンパク質の奥深くでリジン(lysine)アミノ酸を通して結合している。図では3つあるタンパク質鎖のうちの1つを青色で、内部に埋まっているレチナール分子は白色で示している。レチナールは光を強力に吸収する炭素の連なりを持っている。光子が吸収されると、分子の構造変化が引き起こされる。これによってバクテリオロドプシンはまっすぐな形から曲がった形へと変化する。曲がった形については後ほど述べる。この形状変化が水素イオンをくみ出すエネルギーを供給する。
様々なロドプシンの利用
光を捕らえるのは大変有用なので、実はこの好塩性古細菌は4種類ものロドプシン(rhodopsin)を作っている。バクテリオロドプシンはエネルギーを作り出すのに使われる。ハロロドプシン(halorhodopsin、PDBエントリー 1e12など)もポンプの一種で、こちらは水素イオンではなく塩化物イオン(chloride ion)を通す。これは細胞外の塩分の多い条件に適合するように細胞内の塩化物イオン濃度を高く保つ役割を担っている。あと2種類のロドプシンは感覚ロドプシンで、PDBエントリー 1h68や 1jgjがこれに当たる。これらのロドプシンは青い光を感知し、細胞に動くよう信号を送る。これによってより有益な緑の光がある場所を見つける。これら4種類のロドプシンは全て似た工程に沿って、小さなタンパク質の入れ物の内側にレチナール分子を安全に収めて作られる。
光を見る
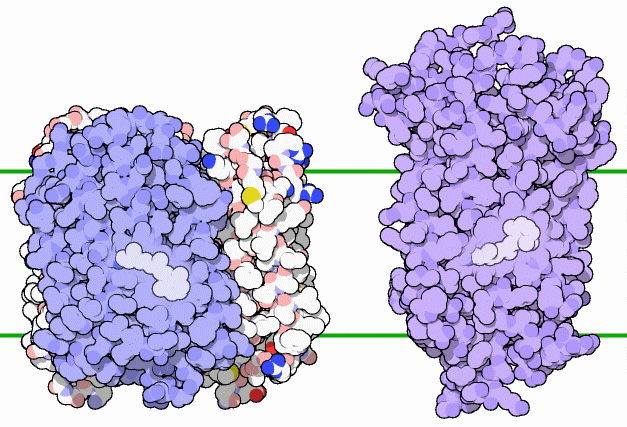
私たちも数種類のロドプシンを作り、これを眼で光を見るのに使っている。バクテリオロドプシンと同様に、私たちのロドプシンもレチナール分子を持っている。(上図左はPDBエントリー 1fbbのバクテリオロドプシン、右はウシから得られたPDBエントリー 1f88のロドプシンである。)レチナールは体内でレチノール(retinol)またはビタミンA(vitamin A)と呼ばれる物質から作られる。これは食物に欠かせないものである、というのも私たち自身でビタミンAを合成することができないからである。ロドプシンの中にあるレチナールが光子を吸収すると、ロドプシンは曲がった形からまっすぐな形へと変化する。これは丁度バクテリオロドプシンと逆である!この形状変化によって周辺のタンパク質が押されて少し形が変化する。これが細胞内のタンパク質によって検知される。その信号が一連のタンパク質を通して次々に伝えられ、最終的に脳への神経信号となる。この過程は大変感度が良く、眼は5個の光子を検知できる。
構造をみる
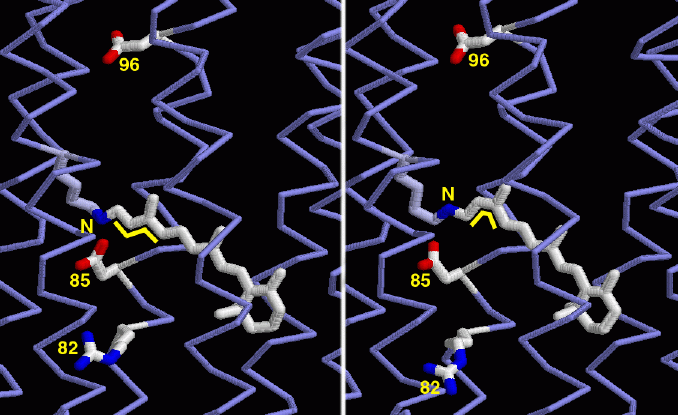
バクテリオロドプシンに関する多くの構造がPDBデータベースに登録されている。これらは光の吸収と水素イオンの排出に多くの過程があることを示している。ここではそのうちの2つをとらえた構造を示す。左の構造は光を吸収する前の基底状態のもの(PDBエントリー 1c3w)である。レチナール(中央を横切っている白く長い分子)はまっすぐなトランス型になっている(そのことが小さな黄色いジグザグで示されている)。一方右に示したのは光を吸収した後(PDBエントリー 1dze)の構造である。こちらはレチナールが曲がってシス型となっていることに注目して欲しい(その部分を黄色い線で示している)。この新たな形になると、レチナールの末端にある窒素(黄色い「N」の文字で示した原子)の配置が変化する。また水素イオンの通り道に沿ったいくつかのアミノ酸(数字を付した箇所)も位置がずれる。特に下にある82番のアルギニンが大きく移動していることに注目して欲しい。この形状変化がどのようにして水素イオンを上から下へ、バクテリオロドプシンの中を通し古細菌の膜を越えさせる力を供給しているのかを明らかにする研究が行われている。
"バクテリオロドプシン" のキーワードでPDBエントリーを検索した結果はこちらで参照できます。
バクテリオロドプシンについてさらに知りたい方へ
以下の参考文献もご参照ください。
- 1999 Closing in on bacteriorhodopsin: progress in understanding the molecule. Annual Review of Biophysics and Biomolecular Structure 28 367-399
- 2000 News and Views: Bacteriorhodopsin -- the Movie. Nature 406 569-570
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









