199: モネリン(Monellin)
砂糖が甘いのには正当な理由がある。砂糖は細胞にとって素早く簡単に使えるエネルギー源なので、それを食べるとき幸せを感じるよう進化してきたのだ。私たちの
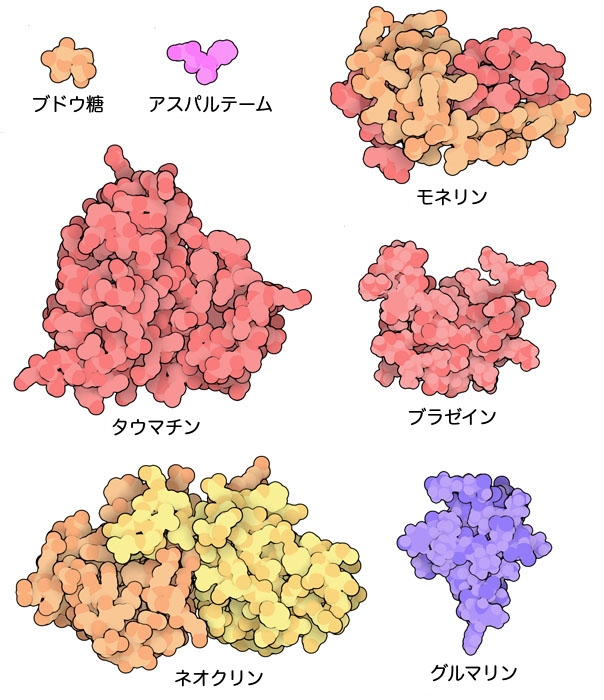
甘味タンパク質
モネリン(monellin、PDBエントリー3mon)、タウマチン(thaumatin、PDBエントリー1thv)、ブラゼイン(brazzein、PDBエントリー2brz)などの強い甘みのあるタンパク質がアフリカの植物から見つかっている。これらの小さなタンパク質は砂糖の100,000倍甘いので、ごく微量で同じ甘さが出せる。このタンパク質が最初に発見されたとき、砂糖分子に似た、少し拡張しただけの分子であろうと予想されていた。ところが構造を解いてみると、そんな姿はしていないことが分かった。くさびのように働いて、活性型構造をとる甘味受容体の動きを封じているのだと現在では考えられている。
味を変えるタンパク質
熱帯植物から見つかった別のタンパク質はさらに変わった性質を持っている。食べ物の味を変えてしまうのだ。ネオクリン(neoculin、PDBエントリー2d04)とミラクリン(miraculin、図示なし)は酸っぱい食べ物を甘い食べ物に変えてくれる。このタンパク質は酸性(=酸っぱい)環境で性質を変えるアミノ酸を持っていて、甘味受容体を刺激し、私たちに何か甘い物を食べたように思わせてくれる。グルマリン(gurmarin、PDBエントリー1c4e)は丁度逆の性質を持っている。砂糖の検知するのを妨げて甘みを抑えるので、甘い食べ物が全く甘く感じなくなる。
甘みの検知
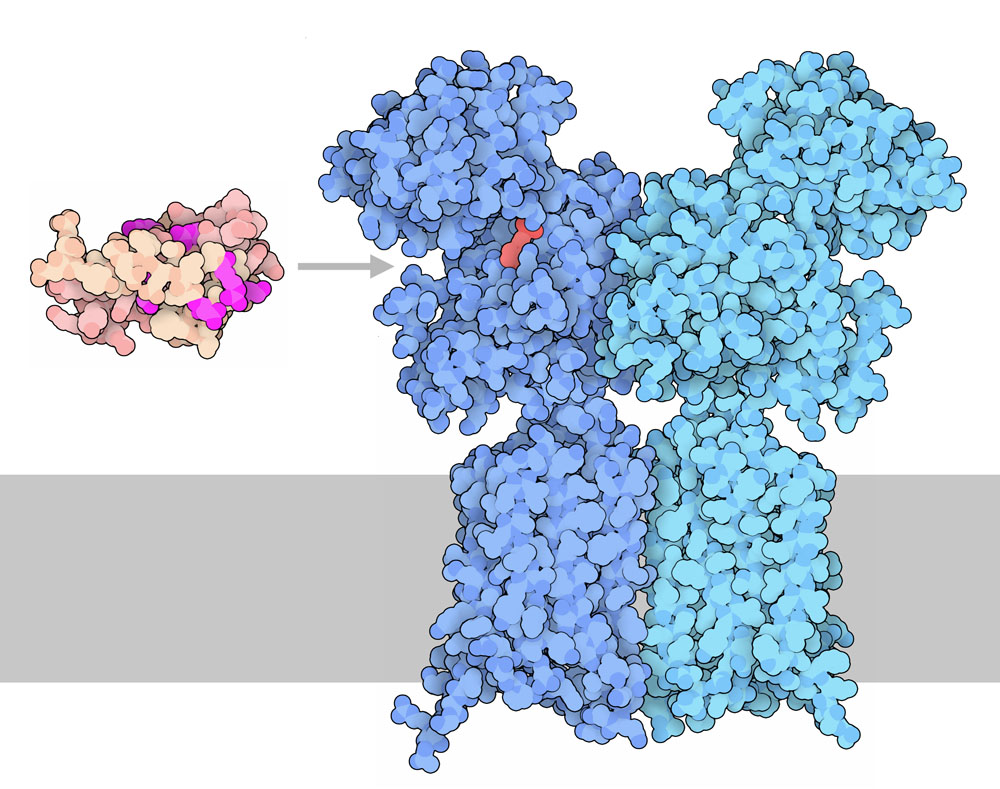
私たちの甘みに関する味覚は、TIR2/TIR3と呼ばれる一種類の受容体によって制御されている。この受容体は、ここに示すグルタミン酸受容体(glutamate receptor、PDBエントリー2e4z、4or2)と似た構造をしている。2つの部分で構成されていて、糖と結合する細胞外ドメインと、膜を貫通していて信号を細胞内に伝える標準的なGPCRドメインがある。モネリンなどの甘味タンパク質は、低分子の糖が結合する部位の周りにある大きな割れ目に結合し、受容体に糖が結合したように思わせているのだと考えられている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
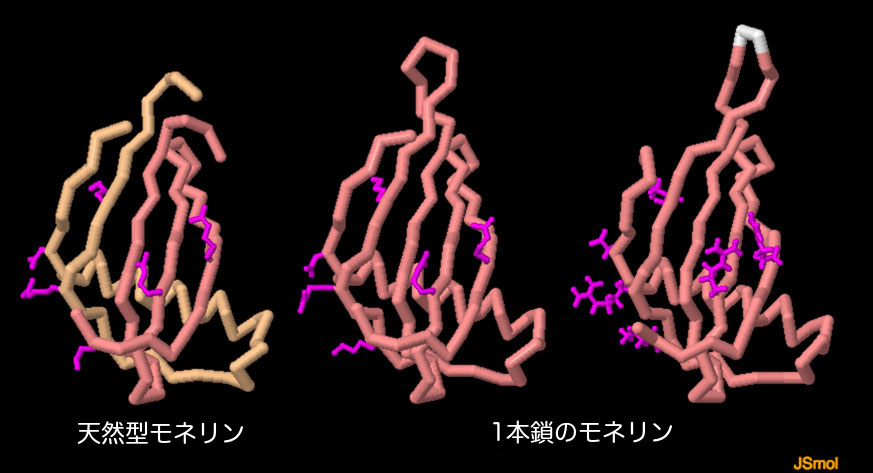
モネリンは非常に甘みが強いので、優れたダイエット食品となり得る。なぜなら微量使うだけで済むからである。ところが、熱するとその甘さは急速に失われるので、加熱を伴う料理には適していない。この問題を解決するため、モネリンが持つ2つの鎖を1本につなげた熱にも安定な型がつくられた。図の下のボタンをクリックし、対話的操作のできる画像に切り替えると、天然型のモネリン(PDBエントリー3mon)と2種類の1本鎖型モネリン(PDBエントリー 1mol、1fa3)をみることができる。
理解を深めるためのトピックス
参考文献
- 4or2 2014 Structure of a class C GPCR metabotropic glutamate receptor 1 bound to an allosteric modulator. Science 344 58-64 DOI:10.1126/science.1249489 PMID:24603153 PMC:PMC3991565
- 2012 Dissimilar sweet proteins from plants: oddities or normal components? Plant Science 195 135-142 DOI:10.1016/j.plantsci.2012.07.001 PMID:22921007
- 2e4z 2007 Structures of the extracellular regions of the group II/III metabotropic glutamate receptors. Proceedings of the National Academy of Science USA 104 3759-3764 DOI:10.1073/pnas.0611577104 PMID:17360426 PMC:PMC1820657
- 2006 Natural sweet macromolecules: how sweet proteins work. Cellular and Molecular Life Sciences 63 1876-1888 DOI:10.1007/s00018-006-6077-8 PMID:16810455
- 2d04 2006 Crystal structure of neoculin: insights into its sweetness and taste-modifying activity. Journal of Molecular Biology 359 148-158 DOI:10.1016/j.jmb.2006.03.030 PMID:16616933
- 1fa3 2001 Solution structure of a sweet protein: NMR study of MNEI, a single chain monellin. Journal of Molecular Biology 305 505-514 DOI:10.1006/jmbi.2000.4304 PMID:11152608
- 1c4e 1999 High-resolution solution structure of gurmarin, a sweet-taste-suppressing plant polypeptide. European Journal of Biochemistry 264 525-533 DOI:10.1046/j.1432-1327.1999.00659.x PMID:10491100
- 2brz 1998 Solution structure of the thermostable sweet-tasting protein brazzein. Nature Structural Biology 5 427-431 DOI:10.1038/nsb0698-427 PMID:9628478
- 1thv 1994 Structures of three crystal forms of the sweet protein thaumatin. Acta Crystallographica D50 813-825 DOI:10.1107/S0907444994005512 PMID:15299348
- 1mol 1993 Two crystal structures of a potently sweet protein. Natural monellin at 2.75 A resolution and single-chain monellin at 1.7 A resolution. Journal of Molecular Biology 234 390-404 DOI:10.1006/jmbi.1993.1594 PMID:8230222
- 3mon 1988 Crystal structures of two intensely sweet proteins. Trends in Biochemical Sciences 13 13-15 DOI:10.1016/0968-0004(88)90011-4 PMID:3072690
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









