196: 鉛の毒(Lead Poisoning)
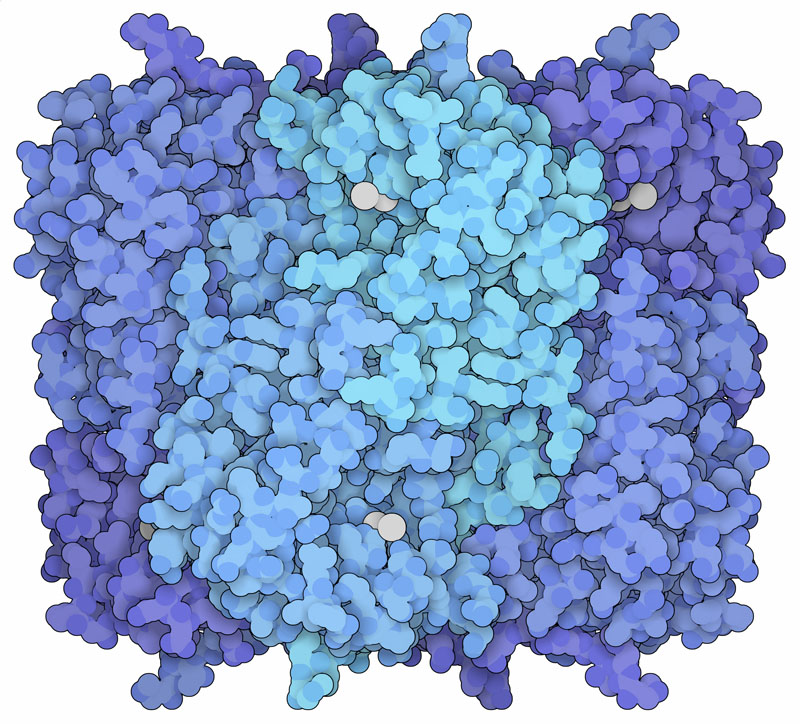
鉛イオン(lead ion)は私たちの細胞では利用されないどころか、むしろ私たちの細胞を継続的な危険にさらす存在である。鉛は環境中でよくある物質であり、また取り出したり整形したりしやすいので、人類の歴史を通して管やステンドグラスの材料、絵の具の鮮やかな白の色素など様々なことに役立てられてきた。だが残念ながら、鉛イオンが体内に入ると、タンパク質と結合して本来あるべき金属イオンと入れ替わり、機能を阻害してしまう。その結果、身体中のタンパク質が毒されてしまうという致命的な事態となりうる。
ヘム作りの妨げ
鉛で毒されるタンパク質の一つに、ヘム合成に関わる5-アミノレブリン酸脱水素酵素(5-aminolaevulinic acid dehydratase、ALAD)がある。この酵素はポルフォビリノーゲン合成酵素(porphobilinogen synthase)とも呼ばれている。ALADはヘム環を作る最初の段階の反応を行っていて、反応を触媒する時に亜鉛イオン(zinc ion)を使う。ここに示すPDBエントリー1qnvの構造において、鉛イオンは亜鉛イオンと置き換えられ、酵素は不活性化している。これにより新たなヘム基の作れなくなり、鉛中毒で見られる症状の一つ貧血(anemia)を引き起こす。
鉛中毒
鉛中毒は慢性的な問題を引き起こす。なぜなら鉛はゆっくりと体内に蓄積されるからである。血液中のタンパク質からは1ヶ月程度でなくなるが、脳には数年、骨には何十年もの間蓄積する。鉛中毒は特に成長中の子供にとって危険である。なぜなら神経系の発達に関わるタンパク質は鉛への感受性が高いからである。そのことを受け、私たちの社会では偶然鉛にさらされてしまう機会を減らす活動が進められている。例えば、鉛入りのペンキやガソリンをなくすといったように。だが今でも問題は起こっている。例えばミシガン州のフリントで、酸性雨と鉛の管との不幸な組み合わせにより鉛汚染が広がった。
鉛とカルシウム
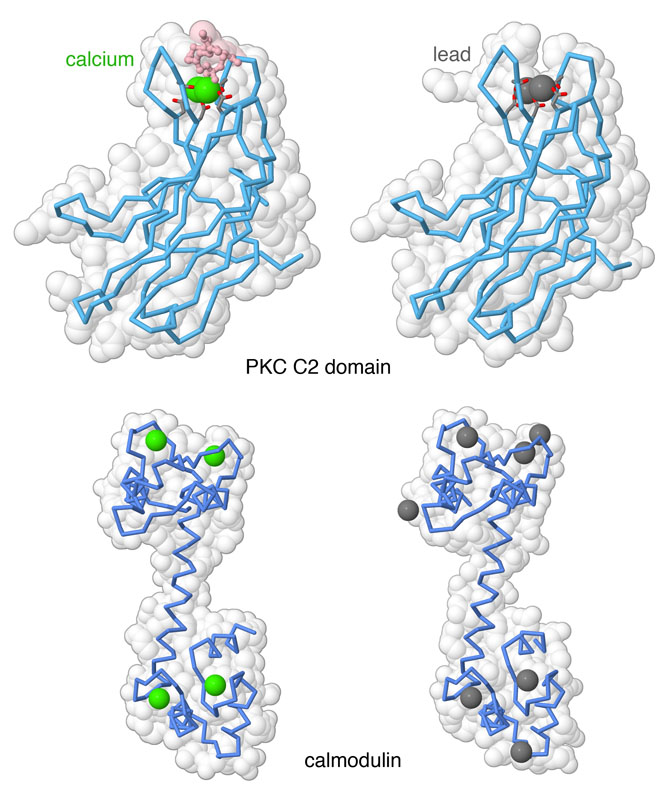
多くの信号伝達タンパク質は、カルシウムイオンの濃度変化を使って細胞活性を制御している。鉛はカルシウム結合部位に結合しカルシウム濃度を検知する機能を妨げて、これらのタンパク質を毒してしまう。ここに2つの事例を示す。タンパク質キナーゼC(protein kinase C)は、2つのカルシウムイオンを使って信号伝達過程中のタンパク質を細胞膜につなぎとめる小さなドメインを持っている。カルモジュリン(calmodulin)は4つのカルシウムイオンをとらえると信号伝達を行う。カルシウムを伴ったタンパク質の構造と鉛を伴ったタンパク質の構造を比べると、どちらのタンパク質もカルシウム結合部位に鉛が結合し、更にその他の部位でも鉛の結合が見られることが分かる(PDBエントリー 1dsy、3twy、1exr、2v01)。
構造をみる
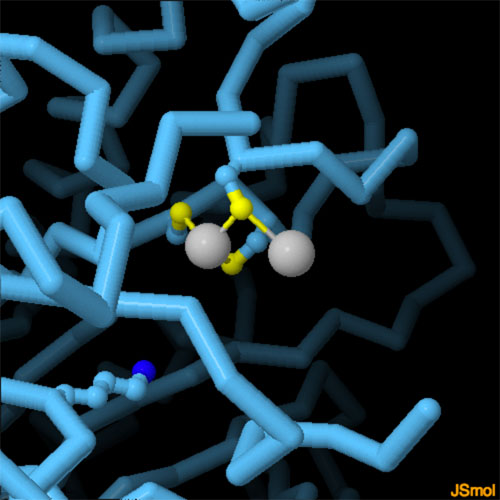
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
酵素は亜鉛イオンやカルシウムイオンをとらえるのに特有のアミノ酸配置を使う。ALADの場合、3つのシステインアミノ酸を三角形に配置して亜鉛イオンを配位させる。またカルモジュリン(calmodulin)のようなタンパク質の場合、カルシウムイオンをとらえる時に酸性アミノ酸がよく使われる。鉛の場合、これら2種類のイオンよりも結合条件はあいまいで、どちらのタイプの結合部位にも結合できる。図の下のボタンを押してALADの亜鉛・鉛結合部位を拡大したり、水銀で毒された類似の構造を見たりしてみて欲しい(PDBエントリー 1ylv、1qnv、1qml)。
理解を深めるためのトピックス
- PDBには鉛が結合した構造が何十個も登録されています。鉛の化合物ページでそのような構造を探してみてください。
- カルシウムの化合物ページや亜鉛の化合物ページでも、鉛に毒されやすい金属タンパク質の構造を見つけることができるでしょう。
参考文献
- 3twy 2011 Pb2+ as modulator of protein-membrane interactions. Journal of the American Chemical Society 133 10599-10611
- 2v01 2007 A structural insight into lead neurotoxicity and calmodulin activation by heavy metals. Acta Crystallographica F63 653-656
- 2006 Cellular mechanisms of lead neurotoxicity. Medical Science Monitor 12 RA57-65
- 1exr 2000 The 1.0 A crystal structure of Ca(2+)-bound calmodulin: an analysis of disorder and implications for functionally relevant plasticity. Journal of Molecular Biology 301 1237-1256
- 1qnv 2000 MAD analyses of yeast 5-aminolaevulinic acid dehydratase: their use in structure determination and in defining the metal binding sites. Acta Crystallographica D56 421-430
- 1ylv 1999 The Schiff base complex of yeast 5-aminolaevulinic acid dehydratase with laevulinic acid. Protein Science 8 1250-1256
- 1dsy 1999 Ca(2+) bridges the C2 membrane-binding domain of protein kinase Calpha directly to phosphatidylserine. EMBO Journal 18 6329-6338
- 1998 Lead poisoning, haem synthesis and 5-aminolaevulinic acid dehydratase. Trends in Biochemical Sciences 23 217-221
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









