195: RAFタンパク質キナーゼ(RAF Protein Kinases)
時としてタンパク質で起きたある一つの変化が大幅な変化につながることがある。このような変化(あるいは変異)は遺伝子の中にある一個のヌクレオチドの変異によって引き起こされるもので、一塩基変異(single nucleotide variant、SNV)と呼ばれている。SNVによってヌクレオチドの変異した箇所に対応するアミノ酸が変化し、変異したタンパク質が作られる。これにぴったりの例として信号伝達タンパク質BRAFの遺伝子が挙げられる。BRAFの遺伝子における一つのヌクレオチド変化が、通常の細胞がメラノーマがん細胞へと変わることを助長する。
信号を送る
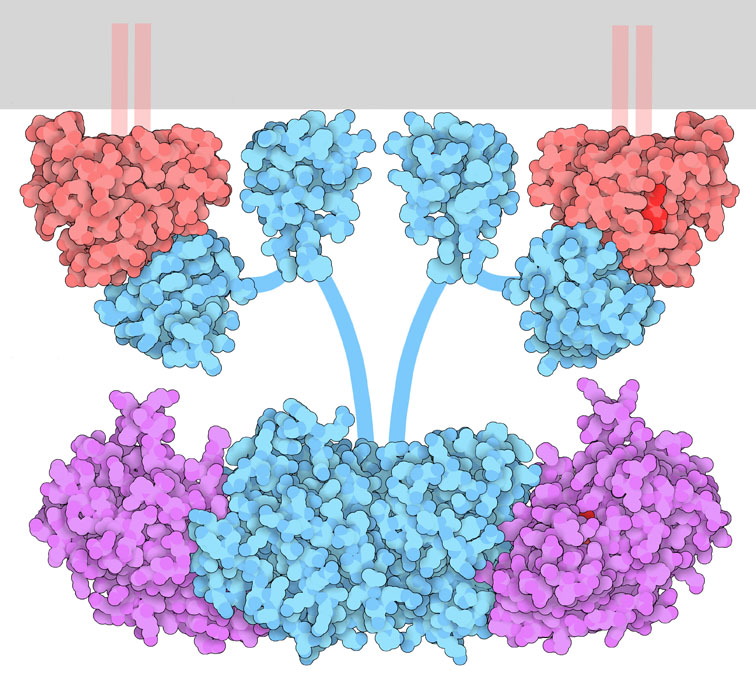
RAFタンパク質は細胞増殖の制御において重要な役割を果たしている。信号伝達の過程は、成長ホルモン受容体(growth hormone receptor)などの受容体が活性化された時に始まる。信号はRASからRAF、MEK、そして最終的にはERKへと細胞内にあるタンパク質の間で受け渡されていく。そして信号は細胞全体に行き渡り、成長に必要な細胞機械が動き始める。このような信号伝達タンパク質の多くは、次のタンパク質の鎖表面にリン酸基を付加するキナーゼ(kinase)と呼ばれるタンパク質である。リン酸基の付加は、活性化につながることが多い。
RASからRAFへ
RAFタンパク質キナーゼはいくつかの機能ドメインで構成された複雑な分子である。今までのところ、そのうちのいくつかのドメインについて研究がなされている。RAFのRAS結合ドメインは、活性化した(PDBエントリー3kud)に結合する。通常は細胞膜の内側に多くのRAS分子がつながっているので、この過程によっていくつかのRAFタンパク質がまとまり、RAFにとっての活性化信号となる2量体化が進む。RAFタンパク質の2つ目のドメインはシステインリッチドメイン(cysteine-rich domain、PDBエントリー1far)と呼ばれており、2量体化を補佐している。恐らく細胞膜の内側表面と相互作用しているのだろう。
RAFからMEKへ
活性状態となったRAF 2量体は、次にMEKをリン酸化して活性化させる。PDBにも登録されている別の構造(PDBエントリー4mne)がこの過程をとらえている。中心にはRAFキナーゼドメインの2量体があり、その外側に2分子のMEKが結合している。柔軟な鎖がRAS結合部位とRAF結合部位をつないでいる。私たちの細胞はRAFに似た形の分子を作っていて、それぞれARAF、BRAF、CRAFと呼ばれている。これらは他の型の分子とヘテロ2量体をよく作り、様々な面で細胞成長の制御を行っている。
発がん性の変異
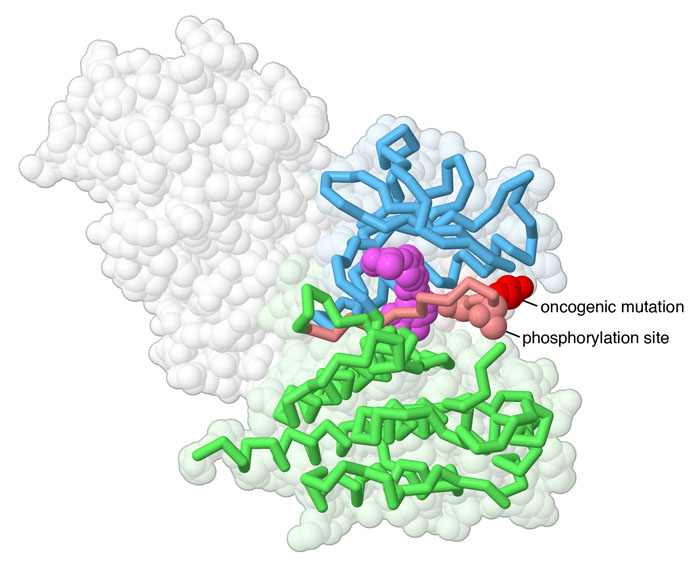
BRAF(ここに示すのはPDBエントリー1uwhの構造)の中にある小さなループは活性化ループ(activation loop)と呼ばれていて、信号伝達の中心となる存在である。BRAFが活性化される時、通常このループは複数の部位がリン酸化され、活性型を形を安定化させるのに寄与している。このループ内にあるある特定のアミノ酸(残基番号600)が発がん性変異の場所である。この位置のアミノ酸がバリンからグルタミン酸になる変化(V600E変異と呼ばれる、Vはバリン、Eはグルタミン酸)によってこのループの位置が休止状態の時の位置からずれ、酵素は常に活性状態になってしまう。この構造変化により、がん細胞は通常の制御を一切受けることなく増殖できるようになる。この変異はRAFをコードしている遺伝子の一塩基変異によって起きる。通常、この変異は悪性細胞でのみ見られ、患者の通常組織には見られない。アメリカ食品医薬品局で認可された薬の一つベムラフェニブ(Vemurafenib)は、RAFのV600E変異体への治療薬として設計された。この変異は致死的な皮膚がんの一種転移性黒色腫(metastatic melanoma)の約半数の患者に見られる。ベムラフェニブの使用は、この薬と並行して開発されたコンパニオン検査(検査方針を決めるための遺伝子検査)によってV600E変異を持っていることが確認された黒色腫患者に限定されている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
変異したBRAF分子の構造に関する知見から、BRAFを阻害しがん細胞の異常な成長を抑える薬が設計できるようになった。これらの種は黒色腫などある種のがんには大変よく効くが、別のがんでは成長を促進してしまうことがある。より詳細に調べたところ、この違いは普通には見られない相互作用によって起きていることが明らかになった。時々BRAFとCRAFはヘテロ2量体を作り、薬はBRAFにしか攻撃していなかったのである。この問題は両方の型の働きを阻害するより高度な薬を使って克服することができた。現在、RAFが2量体を形成し活性化するのを阻害する第2世代の薬の開発が行われている。図の下のボタンをクリックして対話的操作のできる画像に切り替え、ベムラフェニブ(Vemurafenib、PDBエントリー3og7)、ダブラフェニブ(Dabrafenib、PDBエントリー4xv2)、そしてまだ実験段階の薬(PLX7904、PDBエントリー4xv1)、以上3つの構造を見比べてみて欲しい。
理解を深めるためのトピックス
- RCSB PDBのProtein Feature ViewのBRAFページを見ると、RAFドメインの構造がタンパク質の配列全体の中でどのようにはまっているのかが分かるでしょう。
- RAFタンパク質を攻撃する薬の多くは、リン酸化反応に欠かせないATPをまねて設計されています。対話モードページでATPの塩基とリン酸をまねて作った薬分子の位置を確認してみてください。
参考文献
- 4xv1、4xv2 2015 RAF inhibitors that evade paradoxical MAPK pathway activation. Nature 526 583-586
- 4mne 2014 Structure of the BRAF-MEK complex reveals a kinase activity independent role for BRAF in MAPK signaling. Cancer Cell 26 402-413
- 3og7 2010 Clinical efficacy of a RAF inhibitor needs broad target blockade in BRAF-mutant melanoma. Nature 467 596-599
- 3kud 2010 What make Ras an efficient molecular switch: a computational, biophysical, and structural study of Ras-GDP interactions with mutants of Raf. Journal of Molecular Biology 399 422-435
- 1uwh 2004 Mechanism of activation of the Raf-Erk signaling pathway by oncogenic mutations of B-Raf. Cell 116 855-867
- 2004 The Raf proteins take centre stage. Nature Reviews Molecular Cell Biology 5 875-885
- 1far 1996 The solution structure of the Raf-1 cysteine-rich domain: a novel ras and phospholipid binding site. Proceedings of the National Academy of Science USA 93 8312-8317
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









