188: テトラヒドロビオプテリンの生合成(Tetrahydrobiopterin Biosynthesis)
一般的ではない化学反応を行う酵素が別の分子の助けを必要とすることはよくある。20種類ある天然のアミノ酸はそれぞれ異なる化学的特性を持っていて、酵素の化学反応に利用されることはあるが、この20種だけでは十分でないことがある。そんな時酵素は、用途に合った特別な化学的特性を持つ補因子(cofactor)を小さな道具として用い反応を行う。例えば、テトラヒドロビオプテリン(tetrahydrobiopterin)は酸素分子をとらえるいくつかの酵素た利用する補因子で、アミノ酸などの分子に付加される。
補因子を作る
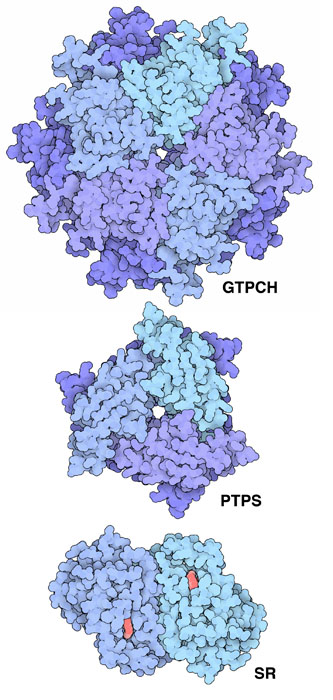
3つの酵素がGTPからテトラヒドロビオプテリンを作っている。最初の段階は反応過程全体の律速段階となっており、GTPシクロヒドロラーゼI(GTP cyclohydrolase I、GTPCH、ここに示すのはPDBエントリー1gtpの構造)と呼ばれる巨大な酵素が実行を担っている。この酵素はグアニン塩基(guanine base)中にある小さい方の環と糖の環を切断した後、両者をつなげて少し大きな環を作る。次に、6-ピルボイル-テトラヒドロビオプテリン合成酵素(6-pyruvoyl-tetrahydropterin synthase、PTPS、PDBエントリー1gtq)が環付近にあるいくつかの原子を入れ替え、リン酸を切り出す。最後に、セピアプテリン還元酵素(sepiapterin reductase、SR、PDBエントリー1sep)が残った糖の一部を整え、補因子を完成させる。
重要な結合
テトラヒドロビオプテリンを必要とする酵素はアミノ酸を作る上でも重要だが、このような酵素の役割として一番に思いつくのは神経伝達物質(neurotransmitter)を作ることだろう。フェニルアラニン水酸化酵素やチロシン水酸化酵素はドーパミン(dopamine)の材料を作る。このドーパミンは、アドレナリン(adrenaline、エピネフリン epinephrine)やノルアドレナリン(norepinephrine、ノルエピネフリン norepinephrine)の材料となる。また、一酸化窒素合成酵素でもテトラヒドロビオプテリンが使われている。この酵素は、体内ではホルモンとして広く用いられる気体の一酸化窒素を作る。テトラヒドロビオプテリンを作る酵素が失われたり変異したりすると、これらの機能を損ない、神経系や心血管系に深刻な問題を引き起こしうる。だが幸いにして、L-ドーパ(L-dopa)などの化合物を補うことによりこのような疾患は治療できる。L-ドーパも、通常であればテトラヒドロビオプテリン依存性酵素によって作られる化合物の一つである。
補因子を再生成する
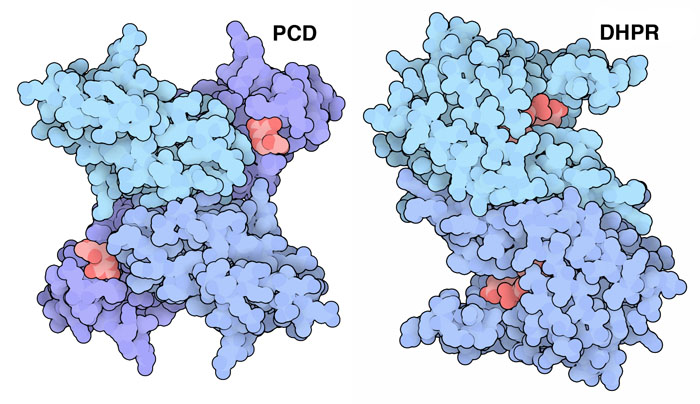
テトラヒドロビオプテリンは補因子として使われる時、酸素分子をとらえて1個の酸素原子を対象分子に付加する。そしてもう一方の酸素原子はテトラヒドロビオプテリンにくっついたまま残る。この不要な酸素を引きはがして補因子を復元するには2つの酵素が必要となる。まず、プテリン-4a-カルビノールアミン脱水酵素(pterin-4a-carbinolamine dehydratase、PCD、PDBエントリー1dcp)が酸素を引きはがし、水分子として放出する。次に、ジヒドロプテリジン還元酵素(dihydropteridine reductase、DHPR、PDBエントリー1dhr)が補因子に水素原子を付加し、これで次の反応への準備が整ったことになる。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
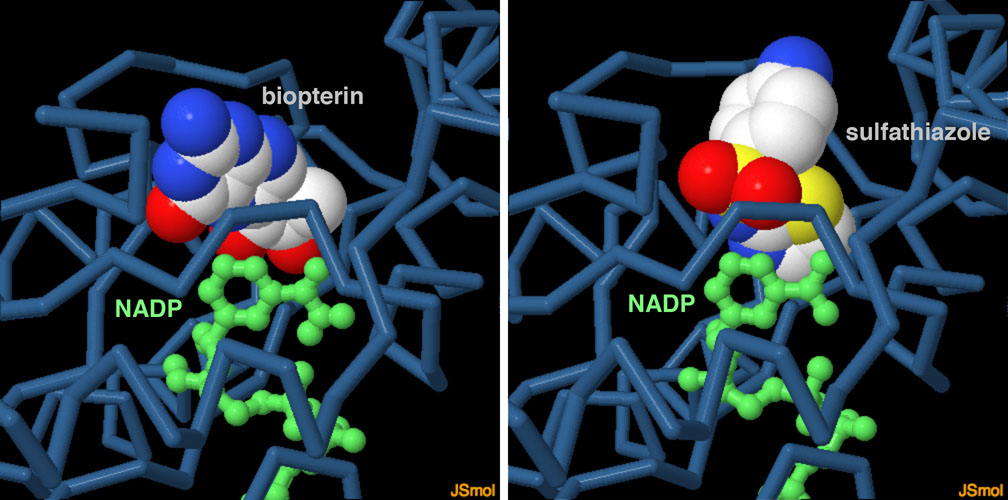
ある最近の結晶学的解析によってサルファ剤(sulfa drug)によって引き起こされる副作用の分子構造的基盤が明らかになった。サルファ剤は1930年代に作られた革新的な薬剤で、細菌感染に対抗する最初の効果的な抗生物質の一つである。しかし、大量に使うと神経系への副作用が起きる。最近解かれた構造(PDBエントリー4j7u)によって、サルファ剤がセピアプテリン還元酵素に結合してその作用を阻害し、最終的に神経伝達物質をつくれなくしてしまうことが明らかになった。図の下のボタンをクリックして対話的操作のできる画像に切り替えると、サルファ剤が結合した構造と、本来意図していた基質が結合した構造(PDBエントリー1sep)の両方を詳しく見ることができる。
理解を深めるためのトピックス
- テトラヒドロビオプテリンが働いている様子を見るには、フェニルアラニン水酸化酵素、チロシン水酸化酵素、一酸化窒素合成酵素の構造を探してみるといいでしょう。
- テトラヒドロビオプテリンについての追加情報をPDBjの化合物ページやRCSB PDBのリガンド概要ページで見ることができます。
参考文献
- 4j7u 2013 Tetrahydrobiopterin biosynthesis as an off-target of sulfa drugs. Science 340 987-991 DOI:10.1126/science.1232972 PMID:23704574
- 2000 Tetrahydrobiopterin biosynthesis, regeneration and functions. Biochemical Journal 347 1-16 PMID:10727395 PMC:PMC1220924
- 1sep 1997 The 1.25 A crystal structure of sepiapterin reductase reveals its binding mode to pterins and brain neurotransmitters. EMBO Journal 16 7219-7230 DOI:10.1093/emboj/16.24.7219 PMID:9405351 PMC:PMC1170322
- 1dcp 1996 High-resolution structures of the bifunctional enzyme and transcriptional coactivator DCoH and its complex with a product analogue. Protein Science 5 1963-1972 DOI:10.1002/pro.5560051002 PMID:8897596 PMC:PMC2143270
- 1gtp 1995 Atomic structure of GTP cyclohydrolase I. Structure 3 459-466 DOI:10.1016/S0969-2126(01)00179-4 PMID:7663943
- 1gtq 1994 Three-dimensional structure of 6-pyruvoyl tetrahydropterin synthase, an enzyme involved in tetrahydrobiopterin biosynthesis. EMBO Journal 13 1255-1262 PMID:8137809 PMC:PMC394939
- 1dhr 1992 Crystal structure of rat liver dihydropteridine reductase. Proceedings of the National Academy of Science USA 89 6080-6084 PMID:1631094 PMC:PMC49441
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









