184: グルカゴン(Glucagon)
血液中に過剰なブドウ糖(glucose)があると、糖尿病(diabetes)などの深刻な問題の発生につながるが、逆に少なすぎても体全体の細胞が飢餓状態に陥るという問題を引き起こす。私たちは主に2種類のホルモンを使って、血中ブドウ糖濃度を丁度いい水準に保っている。この2つのホルモンは
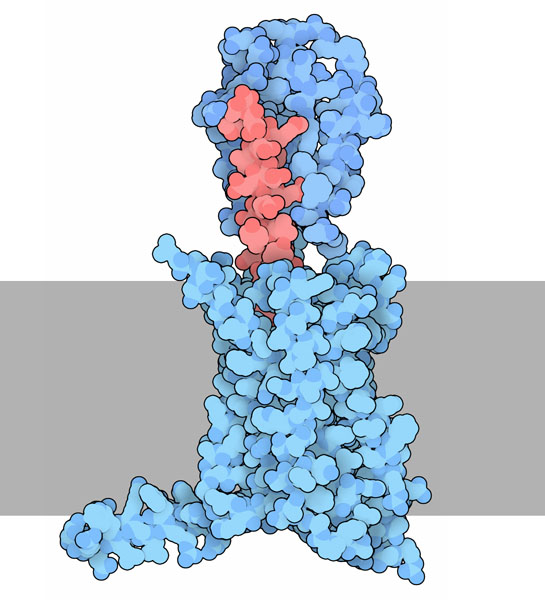
グルカゴンのGPCR
グルカゴン(赤)は細胞のGタンパク質共役受容体(G-protein-coupled receptor、GPCR、青)によって認識される。ここに示す受容体は、アドレナリン受容体(adrenergic receptor)のような通常のGPCRとは少し違っている。細胞外部分にドメインが追加されていて(図の上端部分)、この部分がグルカゴンを捕らえ膜貫通部分へと運ぶ。グルカゴンが結合すると、細胞内のGタンパク質(G Protein)が活性化され、ブドウ糖を放出する一連の反応が始まる。
GPCRを解剖する
グルカゴン受容体の中にはいくつかの可動部分があるため、構造的研究には困難を伴った。ここに示すのは複数のPDBエントリー由来の構造を組み合わせて作った複合体全体のモデルである。折りたたまれて短いαらせんの形を取るグルカゴンは、PDBエントリー 1gcnのホルモン単体の結晶構造から得ている。細胞外ドメインはPDBエントリー 4ers から得たもので、登録されている構造には抗体(antibody)が結合している。特徴的な7本のαらせんが束になった構造を持つ膜貫通部分は、PDBエントリー 4l6r 由来の構造である。
プログルカゴン
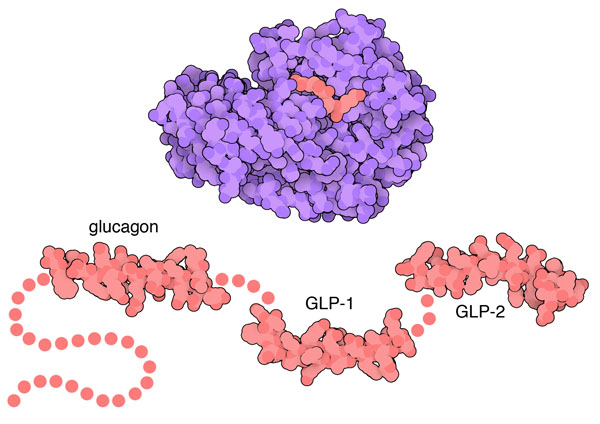
グルカゴンは代謝の管理を助ける類似ホルモン群の一つである。まず、数個の分子をまとめて1本につながった状態で作られる。このタンパク質はプログルカゴン(proglucagon、グルカゴン前駆体)と呼ばれている。次に、プロホルモンコンバターゼ(prohormone convertase、ホルモン前駆体変換酵素)が前駆体を切断し、機能するホルモンができあがる。上図下に示すのはグルカゴン(PDBエントリー 1gcn)、グルカゴン様ペプチド1(PDBエントリー 3iol)、グルカゴン様ペプチド2(PDBエントリー 2l63)の構造である。また上図上に示すコンバターゼはフューリン(furin、PDBエントリー 1p8j)と呼ばれており、プログルカゴンを処理する酵素と似たものである。
構造をみる
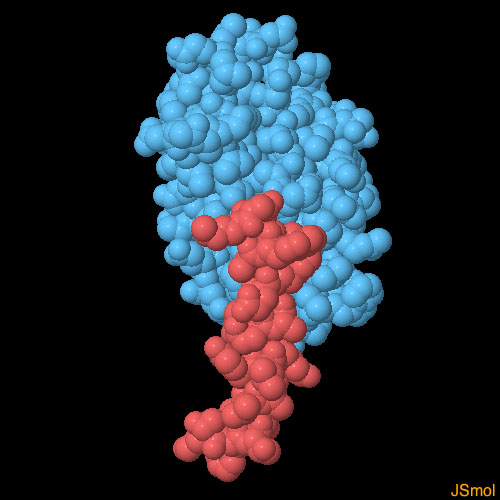
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
グルカゴン受容体の細胞外ドメインはグルカゴンを見つ出すという仕事を担っている。ホルモン分子の短いらせんの端に結合してもう一方の端を遊離させ、膜貫通ドメインにある深い窪みに挿入する。これにより受容体は活性化される。ここに示す構造(PDBエントリー 3iol)はGLP-1が受容体の細胞外ドメインに結合している様子を示している。これはグルカゴンとその受容体に極めて似ている。図の下のボタンをクリックして対話的操作のできる画像に切り替え、この構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
- PDBにはグルカゴン単独の構造、およびその修飾を受けた型の構造がいくつか登録されています。これは、環境によって取る構造にある程度の幅があることを示しています。グルカゴンで検索し、そのうちのいくつかを見てみてください。
- RCSB PDBの「Protein Feature View」を見ると、プログルカゴンから複数個のホルモン分子ができることが分かります。
参考文献
- 2014 The forgotten members of the glucagon family. Diabetes Research and Clinical Practice 106 1-10 DOI:10.1016/j.diabres.2014.06.010
- 2014 Insights into the structure of class B GPCRs. Trends in Pharmacological Sciences 35 12-22 DOI:10.1016/j.tips.2013.11.001
- 4l6r 2013 Structure of the human glucagon class B G-protein-coupled receptor. Nature 499 444-449 DOI:10.1038/nature12393
- 4ers 2012 Molecular basis for negative regulation of the glucagon receptor. Proceedings of the National Academy of Science USA 109 14393-14398 DOI:10.1073/pnas.1206734109
- 2l63 2011 Conformational and molecular interaction studies of glucagon-like peptide-2 with its N-terminal extracellular receptor domain. FEBS Letters 585 346-352 DOI:10.1016/j.febslet.2010.12.011
- 3iol 2010 Crystal structure of glucagon-like peptide-1 in complex with the extracellular domain of the glucagon-like peptide-1 receptor. Journal of Biological Chemistry 285 723-730 DOI:10.1074/jbc.M109.033829
- 1p8j 2003 The crystal structure of the proprotein processing proteinase furin explains its stringent specificity. Nature Structural Biology 10 520-526 DOI:10.1038/nsb941
- 1gcn 1975 X-ray analysis of glucagon and its relationship to receptor binding. Nature 257 751-757 DOI:10.1038/257751a0
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









