18: ミオシン(Myosin)
分子による動き
あなたが今行っている、コンピュータのキーボードを指で打ったり、画面を目で見渡したり、背筋と腹筋を同じ程度に収縮させて快適に座れるようにしたり、といったあらゆる種類の動きはミオシン(myosin)によって動力が供給されている。ミオシンは分子サイズの筋肉で、化学エネルギーを使って意図的な動きを生み出す。ミオシンは細胞内でエネルギーの輸送に用いられるATP分子を捕らえて分解し、それによってエネルギーから動力を生み出している。上腕二頭筋を収縮させたり瞬いたりする時に行う随意動作も、心拍を常時行ったりする不随意の動作も全て、ミオシンが動力を供給しているのである。
ミオシンによる疾走
筋肉が力を発揮する際、ミオシンは大量のATPを必要とする。あなたが走り始めると、筋肉でのATP供給はたった1秒程度で尽きてしまう。そうなると、筋肉細胞はエネルギー源をクレアチンリン酸(phosphocreatine)に変える。これは予備のエネルギー源で、ATP約10秒分に相当するエネルギーに素早く変換することができる。それでもまだ全速力で走り続けると、筋肉はグリコーゲン(glycogen)を使い始める。これはブドウ糖(glucose)を貯蔵している分子である。グリコーゲンは1、2分の間は供給を続けるが、糖が使い果たされると有毒な酸が生成される。そうなると疾走は終わり、筋肉は限界に達する。ただもし、速度を落とし自分のペースで走るなら、筋肉はより長く働くことができる。こうすると血管が拡張して、心拍が上昇し、20倍の血液が筋肉を通過する。筋肉細胞はこの追加で供給される酸素を使って、グリコーゲンに含まれる糖から更に多くのATPを作り出すことができる。これにより短距離走の後ではへたり込んでしまうものの、山登りやマラソンのための資質については持っていることになるのである。
分子筋肉の解剖
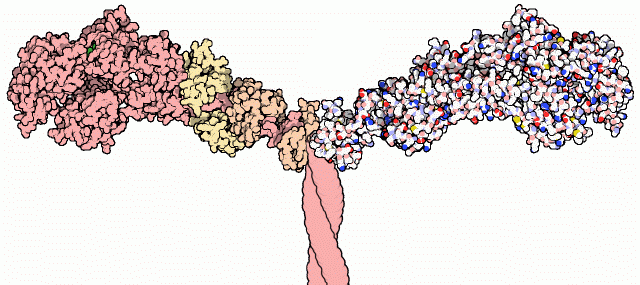
ミオシンは数本のタンパク質鎖からできていて、うち2本は大きな重鎖(heavy chain)、4本は小さな軽鎖(light chain)である。上図に示すようなミオシン分子の一部を含む構造がいくつかPDBには登録されている。上図はPDBエントリー 1b7t から得られたもので、左側については重鎖を赤で、軽鎖を橙と黄で示している。分子全体は次項で示すようにこれよりずっと大きく長い尾を伴っているが、ここでは分子の研究ができるように切断されている。だが幸いにして、結晶構造には力を生み出す働きを担う部分である「モーター」ドメインのほとんどが含まれているため、私たちはこの過程を詳細に見ることができる。
数の力
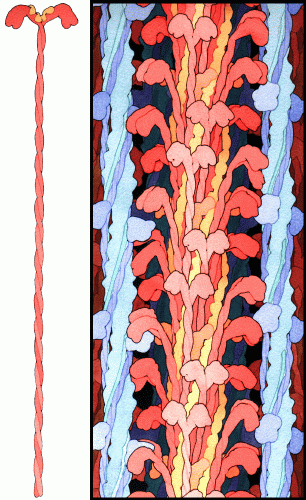
それぞれのミオシンはごく小さな分子の動きをするに過ぎない。野球のボールを持ち上げる力を得るには約2兆個のミオシン分子が必要である。私たちの上腕二頭筋はこの100万倍のミオシンを持っているので、ほんの一部分の分子が努力するだけでよい。協同して働くことにより、それぞれのミオシンが生み出すごく小さな動力は積算されて、私たちになじみある世界で目にする力となるのである。右図はミオシンがどのようにして筋肉細胞内に配置されているのかを示している。約300個のミオシンが結合して、尾も全て含めて強固に集まり、大きな「太い線維」となる。この太い線維の短い断片が、ものさしとして示したミオシン1分子の横に描いてある。太い線維からミオシンの頭部が多数伸びて、青と緑で示したアクチン(actin)線維へと到達しており、太い線維は一つになってこの通路を上っていく。
ミオシンの駆動行程
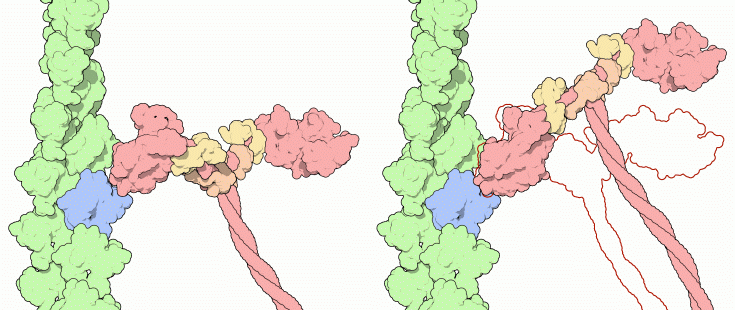
ATPに含まれるリン酸同士の結合は、簡単には作り出せない重要なものであり、細胞内における様々な行程への動力を供給するのに用いられている。しかし、このリン酸間結合の切断はミオシンの駆動行程に直接関与していないと分かれば驚くかもしれない。直接動力供給に関与するのは切断そのものではなく、ATPが切断された後に残ったリン酸の放出なのである。ミオシンが、手前に曲げたり外側に押したりできる腕のようなものだと考えてみて欲しい。ATPの切断は駆動の準備段階で用いられる。ATPが切断されると、ミオシンは上図左(PDBエントリー 1br1)に示すように腕を曲げたような形を取る。これがミオシン駆動の準備となる。そしてこの曲がったミオシンは、アクチン線維(青と緑の部分、PDBエントリー 1atn)をつかんでリン酸を放出し、上図右(PDBエントリー 2mys)に示すようにてまっすぐな「硬直型」(rigid form)になる。この駆動行程によりミオシン分子はアクチン線維に沿って押し出される。1回の駆動が終わると、残ったADPは新たなATPと置き換えられ、ミオシンはつかんでいたアクチン線維を離す。こうして次の動作への準備が整う。
なおこの図にはタンパク質しか示されておらず、タンパク質内部に結合したATP、ADP、リン酸分子は見えていないことに注意して欲しい。ヌクレオチド(ATPやADP)の位置を見るには次項を参照して欲しい。
構造をみる
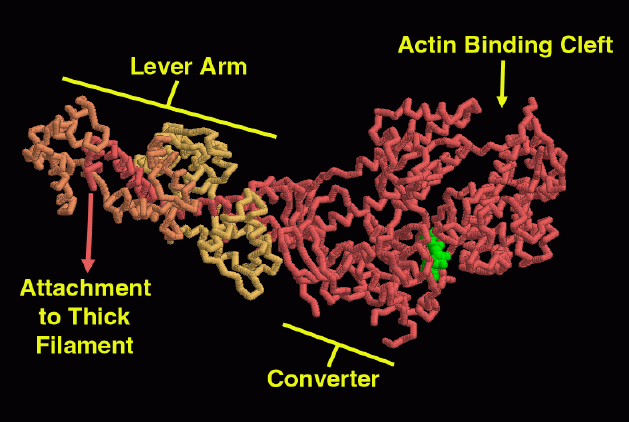
このミオシンモータードメイン(motor domain、PDBエントリー 1b7t)はほぼまっすぐで、硬直型に近い。ここでいくつかの興味深い特徴をみることができる。分子の先端にはアクチンに結合する割れ目がある。この割れ目の底奥深くにADP分子(緑)が結合していることに注目して欲しい。ATPがADPとリン酸に切断され、その後ADPだけになるという反応サイクル中に起こるヌクレオチド中での変化が溝に沿って伝わり、ミオシンがアクチンと相互作用する様式を変化させると考えられている。分子の中央にあるのは変換器ドメイン(converter domain)で、リン酸が放出されると形状が変化する。分子の左側には長いαらせんがあって、その周囲には2つの軽鎖(橙、黄)が結合している。この部分は変換器の形状変化を大きな駆動力に変換する「てこ」の役割をする。
"ミオシン" のキーワードでPDBエントリーを検索した結果はこちらで参照できます。
ミオシンについて更に知りたい方へ
以下の文献も参照してください。
-
2000
The way things move: Looking under the hood of molecular motor proteins.
Science
288
88-95
この記事にはブラウザで参照できるきれいな動画があります。
- 1997 Architecture and function in the muscle sarcomere. Current Opinion in Structural Biology 7 247-257
- 1994 The three-dimensional structure of a molecular motor. Trends in Biochemical Sciences 19 129-134
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









