176: ダイニン(Dynein)
私たちの細胞はモノをあちこち動かすに当たって3種類の主要なモーターに依存している。そしてその全てがATPによって動力が供給されている。ミオシン(myosin)はアクチン(actin)の線維に添って移動するエンジンであり、細胞内における分子サイズの輸送作業だけではなく、筋肉の収縮にも動力を供給している。キネシン(kinesin)とダイニンはどちらも微小管(microtubule)に添って移動するが、多くの場合この両者の輸送方向は逆である。これらの小さな分子モーターが協同して、あらゆるものが適切な場所・適切な時間に存在できるようにしている。
AAA+の仕事
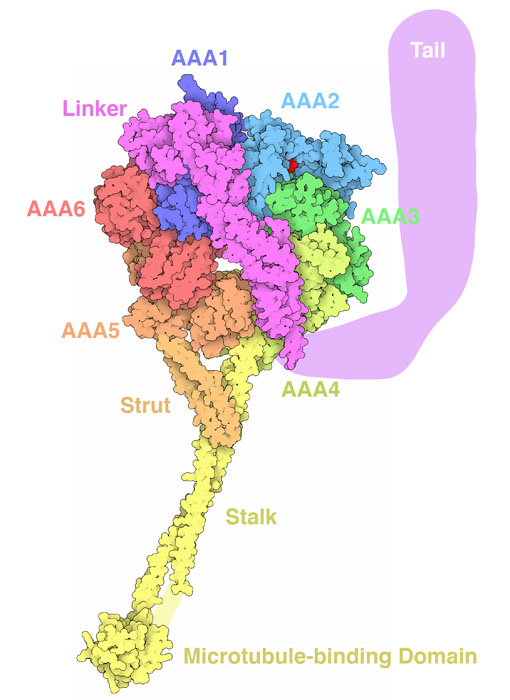
ダイニンは動く部分が大変多いので、研究するのは困難を伴ってきた。ここに示す構造(PDBエントリー 3vkh)が今までのところ最も完全なダイニンの構造である。モーター全体は長い1本の鎖でできていて、折りたたまれ多くの機能ドメインとなる。ダイニンの中心部分は6つのAAA+ドメインが環状に集まってでできているが、これはAAA+プロテアーゼ(AAA+ protease)の中でタンパク質の折りたたみをほどく動力を供給しているエンジンに似ている。このうちの1つ、AAA1ドメイン(右図では濃い青で示した部分)はリンカーと長い尾部(どちらも赤紫で示した部分)につながっている。尾部は通常、2〜3個(個数は種類によって異なる)のダイニンモーターがつながり、輸送する荷物を伴っている。AAA4ドメインは小さな微小管結合ドメインを運ぶ長い柄を作り、それをAAA5ドメインから出ている支柱が支えている。
ナノサイズの巻き上げ機
ダイニンの詳しい動力行程はまだ研究中の領域だが、多くの人はナノメートル(10億分の1m)サイズの巻き上げ機のようであろうと考えている。AAA1ドメインの中でATPが分解されると、そこからリンカードメインが動く動力が供給され、AAA+ドメインが環状に並んだ構造全体が回転する。しかし長い柄の部分は完全に固定されたものではなく、微小管につながったロープのようにはたらいて、モーターの回転に伴い荷物を引っ張る。
結合を作る
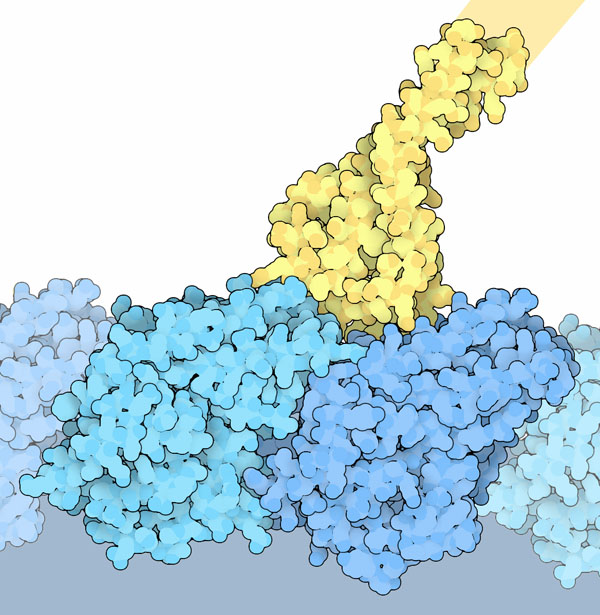
電子顕微鏡を使ってダイニンが微小管につながる様子が研究されている(上図はPDBエントリー 3j1tの構造)。このエントリーにはチューブリンの2量体サブユニット(青)1組と、ダイニンの微小管に結合する柄の短い断片(黄)が含まれている。ダイニンが2つのサブユニットの間にある溝に結合していることがこの構造から分かる。
構造をみる
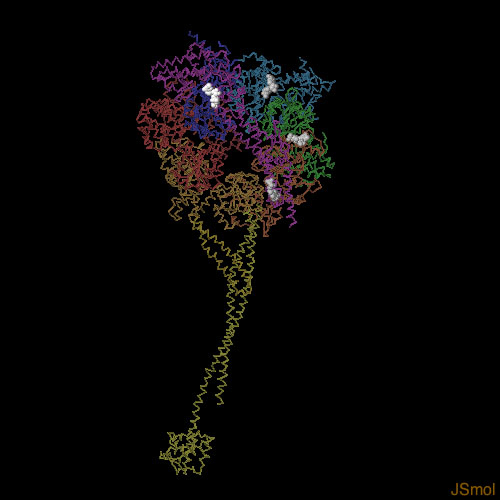
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
ダイニンは4分子のATPと結合するが、そのうち1つ(上部に白で示した分子)しか動力行程に関与していない。残り3つ(灰色)は制御を行う役割を担っていると考えられている。図の下のボタンをクリックして対話的操作のできる画像に切り替え、より詳しく構造を見てみて欲しい。
理解を深めるためのトピックス
参考文献
- 3vkh 2012 The 2.8 A crystal structure of the dynein motor domain. Nature 484 345-350 10.1038/nature10955
- 3j1t 2012 Structural basis for microtubule binding and release by dynein. Science 337 1532-1536 10.1126/science.1224151
- 2014 Structural mechanism of the dynein power stroke. Nature Cell Biology 16 479-485 10.1038/ncb2939
代表的な構造
- 3vkh: ダイニン
- ダイニンはATPによって動力が供給されている分子モーターで、微小管に添って荷物を輸送する。
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









