150: スライディングクランプ(Sliding Clamps)
私たちのゲノムには何千ヌクレオチドものDNAがあって、各タンパク質の配列情報をだけではなく、それら全てを制御するための情報も格納されている。そのため、この情報を複製する必要が生じた時、細胞は長々と伸びたDNAをなんとかしなければならない。だがご想像の通り、細胞内の雑然とした環境の中でこの仕事を行うのは容易ではない。そこで細胞はDNAを複製する際、次のような驚くべき方策を使う。細胞は分子機械を環状のクランプ(clamp 留め具)につなぎ止め、この留め具がDNAに沿って移動することで機械はDNA複製の仕事に専念できるようになる。これにより効率は著しく向上する。例えば、DNAポリメラーゼ(DNA polymerase)をスライディングクランプ(sliding clamp)につなぎ止めることにより、細菌は複製速度を毎秒10塩基対から毎秒100塩基対へと加速できる。また処理能力(DNAポリメラーゼが外れて作業のやり直しが必要となるまでに複製される塩基対の数)は約10塩基対から平均80,000塩基対へと向上する。
クランプローダー

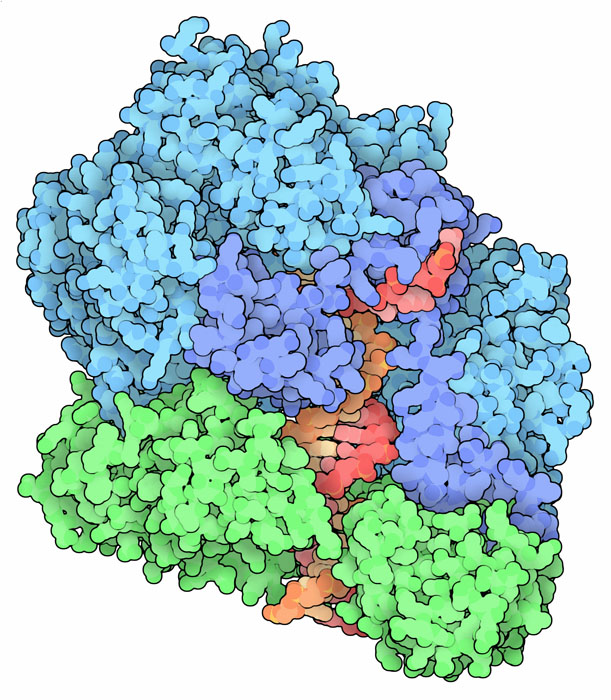
スライディングクランプはDNAを取り囲む。その多くは堅く閉じた環状になっているので、DNAがその中を通って進むにはその環をこじ開ける必要がある。ATPによって動力を供給されて動く「クランプローダー」(clamp loader)はクランプを開き、DNAをその開いた場所に持ってくるという仕事を行う。ここに示した構造はバクテリオファージ(bacteriophage)由来の構造(PDBエントリー 3u5z)で、開かれたたクランプを緑で、DNAを赤と橙で、クランプローダーを青で表している。また細菌や真核生物から得られた閉じた状態のクランプローダーについても構造が解かれている。それらは全て構造も機能も似ている。それらはクランプをつかんで、押し広げ、DNAが内部に結合できるようにする。この過程の大半は独特ならせん型のローダーによって推し進められるが、その間クランプは開いたロックワッシャー型の形状が維持される。そして最終段階でATPが使われ、最終的にクランプとDNAの複合体が放出される。
クランプで固定された酵素
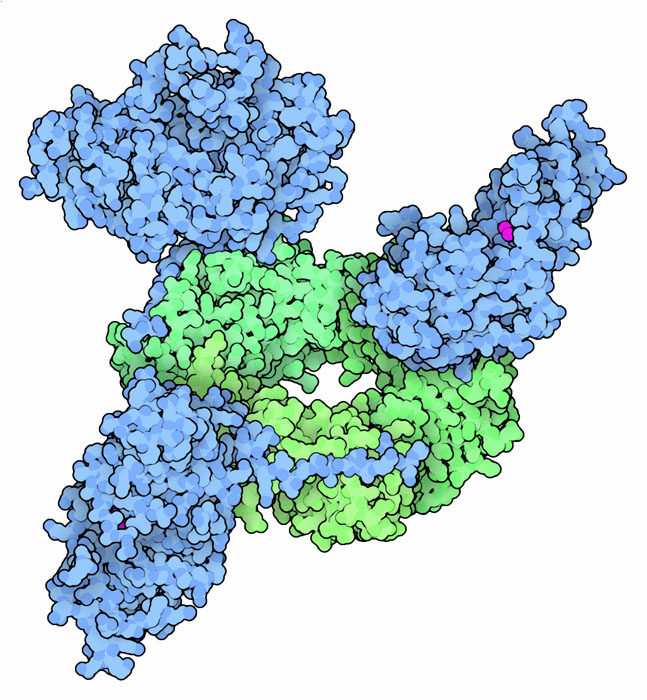
クランプはDNAポリメラーゼが行う不可欠な仕事が確実にできるようにしてくれているが、DNAに作用する他の酵素にも利用されている。ここに示すその一例「FEN1」(flap endonuclease 1、PDBエントリー 1ul1)はDNA複製を開始する際用いられる短いRNAプライマーを切り取って除去する酵素である。この構造には3種類の異なるサブユニットで構成されたクランプ(緑色)と3つのFEN1分子(青色)が含まれている。酵素は柔軟な結合部分(flexible linker)を介してクランプにつなぎ止められており、これによって酵素が適切な場所に位置し、中を縫うようにして進んできたRNAプライマーを攻撃できるようにしている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
PDBエントリー 3u5z にはクランプ・DNA・クランプローダーの複合体が2つ含まれていて、一方は開いたクランプ、もう一方は閉じたクランプとなっている。ここに示すのは開いた方のクランプである。これを見ると2本あるDNA鎖の一本(鋳型鎖)がもう一本より長くなっていることが分かるだろう。クランプはこの後、伸長中の短いDNA鎖におけるDNAポリメラーゼの働きを助ける。クランプローダーが持つ5つのサブユニットそれぞれの間にはATP結合部位もみられる。ただここに結合しているのは切断することができないATP類似物質(赤紫色)である。開いた型と閉じた型を比較するため、画像の下にあるボタンをクリックして対話的操作のできる画像に切り替えてみて欲しい。
理解を深めるためのトピックス
- 他の生物に由来するクランプローダーの構造もPDBに登録されています。それらはどれも似ていて、5つのサブユニットがらせん状に配置された構造を持っていることに注目してください。
- 3つのサブユニットから成るスライディングクランプを用いる生物もいれば、2つのサブユニットから成るスライディングクランプを用いる生物もいます。その両方のタイプの構造をPDBで見つけることができますか?
参考文献
- 2012 Clamp loader ATPases and the evolution of DNA replication machinery. BMC Biology 10 34
- 2011 The role of the DNA sliding clamp in Okazaki fragment maturation in archaea and eukaryotes. Biochemical Society Transactions 39 70-76
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









