136: ナノボディ(Nanobodies)
自然には例外がたくさんあるが、時にはその例外が例外的に有用となる場合がある。1993年、フタコブラクダ(bactrian camel)、ヒトコブラクダ(dromedary camel)、ラマ(llama)の抗体(antibody)は1種類のタンパク質でできていることが発見された。後に、同様に1種類の鎖でできた抗体がサメからも見つかっている。これは生物学的には変わったことの一つに過ぎないのだろうが、これら珍しい分子が持つ性質は、バイオテクノロジーや医薬にとってはより良い道具となる重要な要素となることが分かっている。
抗体の代替品
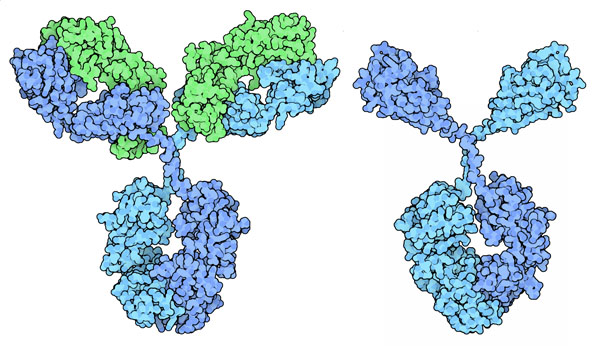
私たち人類および多くの脊椎動物の血液中にある抗体は2種類の鎖からできている(上図左)。大きい方の重鎖(heavy chain、青色部分)は2つの役割を担っている。重鎖はもう一つの重鎖と一緒になってY字型をした抗体の基幹部分を形成する。これに2つの小さな軽鎖(light chain、緑色部分)が結合して重鎖と一緒になり、各腕の先に抗原結合部位(antigen-binding site)を形成する。ところがラクダの抗体の中には、完全に軽鎖を伴わずに抗原結合部位を形成しているものがある(上図右)。2つの腕部は重鎖の先端部が切り取られたものでできており、各腕の重鎖が単独で抗原認識の仕事を全てこなしている。
素晴らしいFab(Fabulous Fabs)
抗体の断片は科学技術や医薬の分野で広く用いられている。抗体の腕部を切り出すと、Fab(Fragment antigen binding、抗原結合性フラグメント)として知られる小さな分子になる。それぞれのFabには、対象分子(抗原)に結合する小さな部位が含まれる。このFabを細胞表面タンパク質に結合させると、損傷を受けた細胞や悪性細胞を検知する診断の道具として利用できる。また蛍光分子に結合させると、細胞内における対象分子の位置を画像化するのに使える。Fabをウイルスタンパク質と結合させれば、そのFabはウイルスに対抗する薬として用いることができる。ただ残念ながら、Fab分子は比較的大きく2本の鎖で構成されているため、私たちが望むこのような用途に使えるほど安定ではない。そこで、ナノボディ(nanobody、単一ドメイン抗体)の登場となる。
ナノボディ
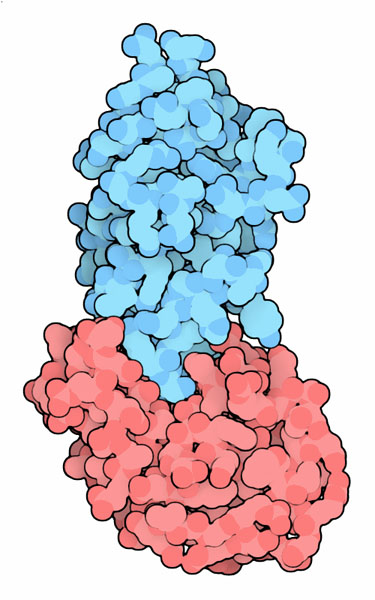
ナノボディはラクダ由来の珍しい抗体から得られた断片と似ている。腕部が切り出され、抗体のFabに似ているがより小さくより安定な分子となっている。これはある決まった対象分子に対して極めて特異的に結合する。右図に示す分子(PDBエントリー 1mel)の場合、リゾチーム(lysozyme)へ特異的に結合する。この図において、ナノボディは青で、リゾチームは赤で示している。これは既に研究で用いられているが、現在薬として利用するための研究が進められている。
構造をみる
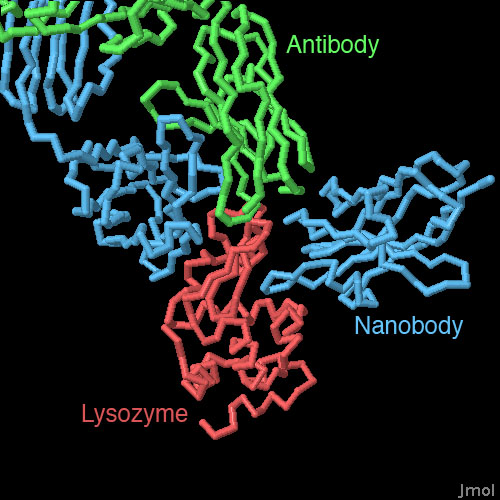
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
ナノボディは大変小さいため、通常は他の抗体に比べてより小さな部分で対象分子と相互作用する。これが長所となることが、リゾチームに結合したナノボディ(PDBエントリー 1mel)と、リゾチームに結合した一般的な抗体のFabとを比較することにより明らかになった。ナノボディには指型の環状領域があり、その部分がリゾチームの活性部位に入り込んで、本来の基質に似た相互作用を形成する。一方、通常の抗体は大きなカップ型の結合部位を持っていて、活性部位に入り込むことはできない。その代わりにリゾチームの一側面をしっかりつかむことで、ナノボディと同様に対象分子の活性を阻害している。上図下のボタンを押して対話的操作のできる画像に切り替え、サメのナノボディやリゾチームの基質の構造とともにを見比べてみて欲しい。
理解を深めるためのトピックス
参考文献
- 2009 Camelid immunoglobulins and nanobody technology. Veternary Immunology and Immunopathology 128 178-183
- 2009 Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Medical Microbiology and Immunology 198 157-174
- 1993 Naturally occuring antibodies devoid of light chains. Nature 363 446-448
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









