041: ヘモグロビン(Hemoglobin)
赤い血、青い血
なぜ血管が青く見えるのか不思議に思ったことはないだろうか? 酸化された血液は鮮やかな赤色をしている。切り傷をつくった時に見る血液は鮮やかな酸化された血液である。脱酸化された血液はくすんだ紫色である。献血をするときや病院で採血をするとき、酸素(oxygen)から隔離された貯蔵管に入れられるので、この血液はくすんだ紫色に見える。ところが、くすんだ紫色の脱酸化された血液が静脈を通るときは青く見える(特に色白の人の場合)。これは色によって皮膚の通り方が違うことによる。青い光は皮膚の表層で反射されるが、赤い光は皮膚のより深いところまで通り抜ける。静脈中にあるくすんだ色の血液はこの赤い光のほとんどを吸収する(青い光も吸収されるが赤色の方がずっと多く吸収される)。私たちが見る青い光は皮膚の表面で反射されたものである。一方、ヘビやカニなどの生物は酸素の輸送に銅(copper)を使っていて、本当に青い血を持っている。
()は血液を赤くしているタンパク質である。4つのタンパク質鎖で構成されており、うち2つはα鎖、残り2つはβ鎖である。それぞれ1個の鉄原子(iron atom)を含んだ環状のヘム基(heme group)を持っている。酸素は可逆的にこの鉄原子と結合し、血液中を運ばれる。各タンパク質鎖はミオグロビン(myoglobin)の構造と似ている(ミオグロビンは筋肉などの組織中に酸素を蓄えるのに用いられるタンパク質で、2000年1月の「今月の分子」で紹介している)。ところが、の4鎖は次に述べるようにさらに追加の利点を持っている。
の利用と誤用
は酸素だけではなく、一酸化窒素(nitric oxide、NO)や一酸化炭素(carbon monoxide、CO)のような他の分子とも結合し輸送することができる。一酸化窒素は血管壁に作用し血管を弛緩させる。これによって血圧は低下する。最近の研究で、一酸化窒素は中にある特定のシステイン(cysteine)残基とヘム基の鉄どちらにも結合できることが分かった。そのことがPDBエントリー 1buwの構造で示されている。こうして、は血液を通じて一酸化窒素の供給することにより血圧制御に寄与している。一方、一酸化炭素は有毒なガスである。一酸化炭素はヘム基の酸素と置き換わり、除去が難しい安定な複合体を形成してしまう。その様子をPDBエントリー 2hcoなどで見ることができる。このように誤ったヘム基の使い方をすると、正常な酸素の結合と輸送が阻害され、周辺の細胞が窒息する。
人工血液
輸血(blood transfusion)は数え切れない生命を救ってきた。ところが、輸血の際血液型を一致させる必要があること、貯蔵した血液の使用期限は短いこと、汚染の可能性があることが未だ重要な懸念事項となっている。がどのように働いているかの理解が、何十年にもわたる生化学的研究と多くの結晶構造に基づいて行われ、血液の代替品や人工血液の探究が試みられてきた。最も明白な方法は、純粋なの溶液を失われた血液の代わりに使うというものである。そこでの主たる課題は、どうやってを構成する4つのタンパク質鎖を一緒にしたまま保つかということである。赤血球細胞という保護容器がないと、4つの鎖はすぐばらばらになってしまう。この問題を回避するため、ここに示す4鎖のうちに2つを物理的に結合した新たな分子(PDBエントリー 1c7d)が設計された。この構造では、追加された2つのグリシン(glycine)残基が2つの鎖をつなぎ、溶液中で分離するのを防いでいる。
のいとこ
PDBデータベースを見ると、様々な種類の分子が見つかるだろう。ここに示したのは、マックス・ペルーツ(Max Perutz)による草分け的構造、ウマの(PDBエントリー 2dhb)の構造である。またヒトのは、大人のものと胎児のもの両方が登録されている。更に、豆類に見られるレグ(leghemoglobin)のように普通とは違うもある。これはマメ科植物の根で窒素固定を行っている酸素感受性細菌を守っていると考えられている。この数年の間に「切り捨てられた」(truncated hemoglobin)と呼ばれるのいとこが特定された。これはPDBエントリー 1idrなどで見ることができ、典型的なからいくつかの部分がなくなった構造をしている。これらタンパク質サブファミリーの間で絶対的に保存されている唯一の特徴は、ヘム鉄に結合するヒスチジン(histidine)アミノ酸の存在である。
協力によってより簡単に
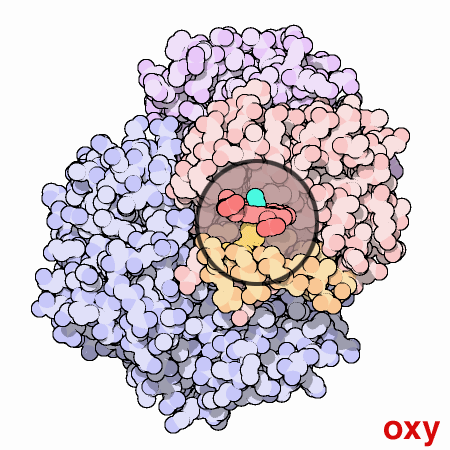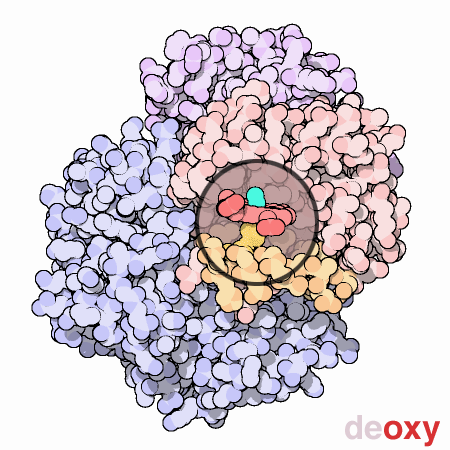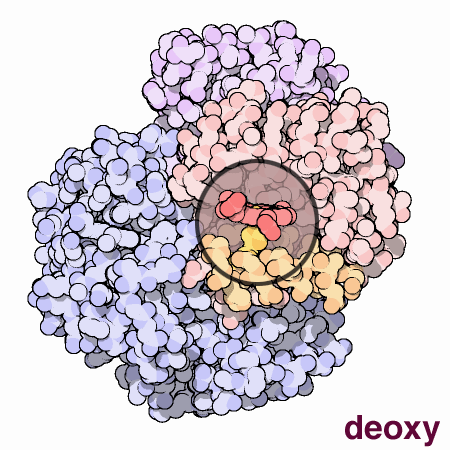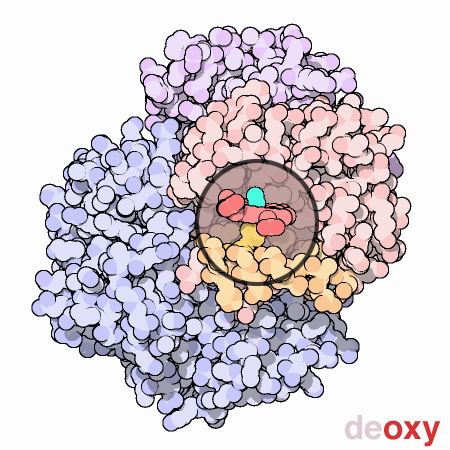
はその活動を制御するのに動きと小さな構造変化を使う素晴らしい分子機械である。にある4つのヘム部位への酸素結合は、同時には起こらない。最初のヘムに酸素が結合すると、そのヘムを含むタンパク質鎖に小さな構造変化が起こる。この変化によって隣の鎖が少し押されて形状変化が起こり、より酸素が結合しやすくなる。このようにして、最初の酸素分子は付け加えにくいが、2つ目、3つ目、4つ目となるに従い徐々に追加しやすくなっていく。このことはの機能において大変な利点となる。血液が肺にある時、そこには酸素が豊富にあるため簡単に最初のサブユニットに酸素が結合し、速やかに残りのサブユニットにも酸素が満たされる。そして血液が身体の各部を循環するに従い酸素濃度は低下し、二酸化炭素濃度が上昇していく。この環境下では、は酸素を解離する。最初の酸素分子が離れるとすぐに、タンパク質の構造は変化し始める。このことが残りの酸素の速やかな解放を促す。こうしては、肺にある酸素という荷物を最大限積み込み、全ての必要な場所へ必要な時に酸素を供給しているのである。
ここに示した動画では、1つのサブユニット中にあるヘム基を小さな丸い窓で示した。この窓は、酸素が結合した際ヘム基周辺でタンパク質がどのように動くのかが分かるよう、一箇所に固定して表示されている。酸素分子は水色で示した。ヘム中央にある鉄原子に結合すると、ヘムの底にあるヒスチジンアミノ酸が上に引っ張り上げられる。この動きによって橙色で示したヘムの下にあるαらせん全体が移動する。それが更にタンパク質鎖全体、更に他の鎖へと広がり、最終的に青で示した2つのサブユニットに対する大きな動きを引き起こす。なお、ここに示した構造はPDBエントリー 2hhb と 1hhoから得られたものである。
問題の生じた
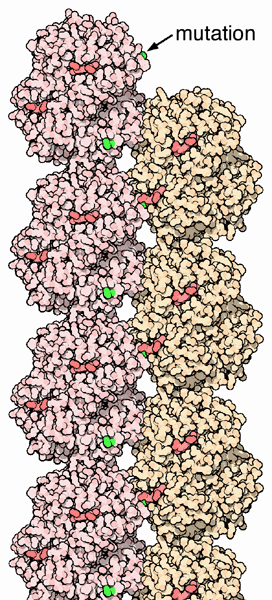
タンパク質鎖の遺伝子はヒトによって少し違いがあることを示している、つまりのアミノ酸配列はヒトによって若干の違いがある。多くの場合、変化はタンパク質の機能には影響せず、注目さえされないことも多い。ところが、場合によって大きな構造変化を引き起こす。その一例が鎌状赤血球(鎌形赤血球、sickle cell hemoglobin)で、β鎖の6番目にあるグルタミン酸(glutamate)がバリン(valine)に変異したものである。この変化によって酸素非結合型(PDBエントリー 2hbs)は互いにくっついて、赤血球細胞内での堅い線維が形成される。これによって赤血球の形が変形し、通常滑らかな円盤状をしているものが「C」の文字のような鎌形になる。曲がった赤血球は壊れやすくてよく破裂し、の損失を招いてしまう。これは一様に悲惨なことのようにみえるかもしれないが、ある環境下ではそれどころか利点となるのである。熱帯性疾患のマラリア(malaria)を引き起こす寄生生物は、生活環の一部を赤血球の内部で過ごすが、線維で満たされた鎌状赤血球の中では生きられないのである。そのため鎌状赤血球を持つ人々は多少マラリアに抵抗性がある。問題のあるに起因するまた別の事態が、αサブユニットとβサブユニットを作る時の不適合があった時に発生する。を作るには両方のタンパク質を同じように作る必要があるが、もし一方がなくなると、サラセミア(地中海貧血症、thalassemia)と呼ばれる病気を引き起こす。
構造を見る
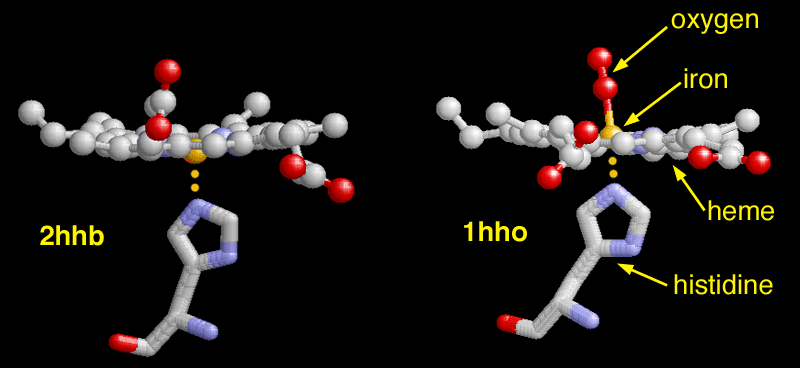
ヒトのの2つの構造で酸素の結合を間近で見ることができる。PDBエントリー 2hhb(図左)は酸素が結合していないを示している。この図では、横向きになったヘムに金色で示した鉄原子が結合しているのが分かる。重要なヒスチジンが下から近づいて鉄原子に結合しているのを見える。一方、PDBエントリー 1hhoでは酸素が鉄に結合し、鉄が上に引っ張られている。次に下のヒスチジンが引っ張られ、タンパク質鎖全体の位置が変化する。これらの変化はタンパク質全体に伝わり、最終的に隣接する部位の結合力を変える大きな形状変化を引き起こす。
PDBエントリー 1hhoには構造に含まれる4つの鎖のうち2つしか含まれていない。4つの鎖全部を含む構造を見るには、生物学的分子(biological molecule)を作って見る必要がある。
"" のキーワードでPDBエントリーを検索した結果はこちらで参照できます。
についてさらに知りたい方へ
当記事を作成するに当たって用いた参考文献を以下に示します。
- 1978 Hemoglobin structure and respiratory transport. Scientific American 239 6
- 2002 Artificial blood. Science 295 p1002
- 2002 New therapies in sickle cell disease. Lancet 24 p629
- The Skinnyon Blue Blood. Discover Magazine December 1996.
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









