032: シャペロン(Chaperones)
PDBデータベースに登録されている多くの構造を見ていると、活性のあるタンパク質のほとんどは安定で、球状の構造をしていることが分かる。ところが、タンパク質は最初、リボソーム(ribosome)においてアミノ酸を一度に1個ずつ付加して作られた形のない鎖として作られる。ほとんどのタンパク質鎖はその後自然に最終的な形へと折りたたまれるが、これは炭素が豊富な部分を分子の周囲にある水から保護する必要によって導かれるものである。ところが大きなタンパク質や数個のドメインでできているタンパク質の中には、折りたたむのに補助が必要なものもある。コンパクトな形に折りたたむ際、途中で行き詰まるおそれがあるからである。
誤った折りたたみの危険
これはささいな問題ではない。細胞はタンパク質が正しく折りたたまれるのをただ待っていることはできない。誤って折りたたまれたタンパク質は、本来安全に内側にしまい込まれているはずの炭素が豊富な部分を表面に出していることがよくある。炭素が豊富な部分は他のタンパク質の似たような部分と強く結合し、大きな凝集体を形成する。ランダムな凝集体は細胞にとって致死的である。鎌形赤血球貧血(sickle cell anemia)、狂牛病(mad cow disease)、アルツハイマー病(Alzheimer's disease)などの病気は、異常なタンパク質の凝集が細胞の動きを妨げる原線維(fibril)となることで引き起こされる。
折りたたみの経路に沿った案内
シャペロン(chaperone)は、タンパク質を正しい過程に従って折りたたまれるのを誘導するタンパク質である。折りたたみ過程中そのタンパク質を保護し、他のタンパク質が結合したり折りたたみ過程を邪魔したりしないようにしている。多くのシャペロンタンパク質は「熱ショックタンパク質」(heat shock protein)と呼ばれ、HSP-60のように名付けられている。こう呼ばれるのは細胞が熱にさらされた時大量に作られるからである。一般的に熱はタンパク質を不安定化させ、誤った折りたたみをより起きやすくしてしまう。だから本当に熱くなった時、細胞はこれらシャペロンの追加支援を必要とするのである。
HSP-60シャペロン
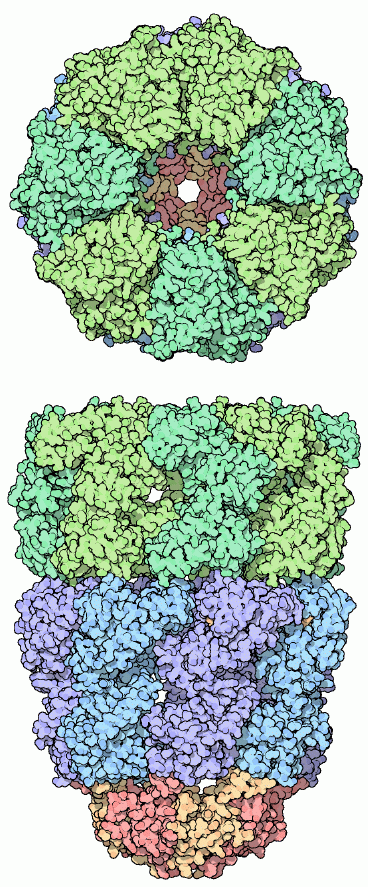
ある優れたシャペロンは、折りたたむタンパク質を閉じこめる環境を作り、タンパク質を折りたたむ間ずっと保護してくれる。ここに示したのはPDBエントリー 1aonから得られた大腸菌のGroEL-GroES複合体の構造である。2段重なった環状のGroEL(青と緑で示した分子)と、その一方の側にかぶさったGroES(底に赤と黄色で示した分子)で構成されている。上の図に示されているように、7つのGroELタンパク質が環になって、折りたたみを助けるタンパク質の大きさをした空洞を作っている。折りたたまれていないタンパク質はこの空洞に入って、この中で折りたたみを完成させる。
HSP-70と折りたたみの前段階
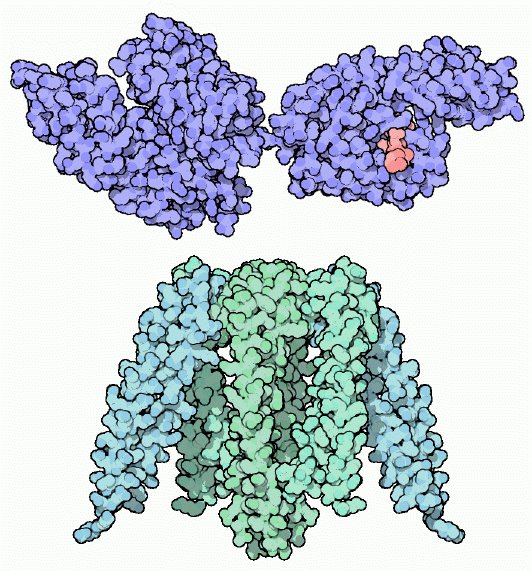
小さなシャペロンがリボソームを離れた直後のタンパク質を保護している。この段階のタンパク質は、ほとんど折りたたまれていない構造をしているだろう。このような露出した炭素原子をたくさん持つ伸びた鎖は特に凝集する危険が高い。HSP-70(図上)はこのような伸びた鎖を見つけて結合し、隣接する他の分子から保護する。そして折りたたみの準備ができると、シャペロンはATPの力によって鎖を解放する。HSP-70は2つのドメインで構成されている。一方はATPに結合して過程を制御する(図左上、PDBエントリー 1dkg)ドメイン、もう一方は炭素が豊富なペプチドに結合する(図右上、PDBエントリー 1dkz)ドメインである。ピンク色で示した小さなペプチドが、タンパク質が結合する溝に結合している。図下に示した、奇妙なクラゲ型をしたプレフォールディン(prefoldin、PDBエントリー 1fxk)も似たような仕事をしており、折りたたみ中のタンパク質鎖を取り込む。
構造をみる
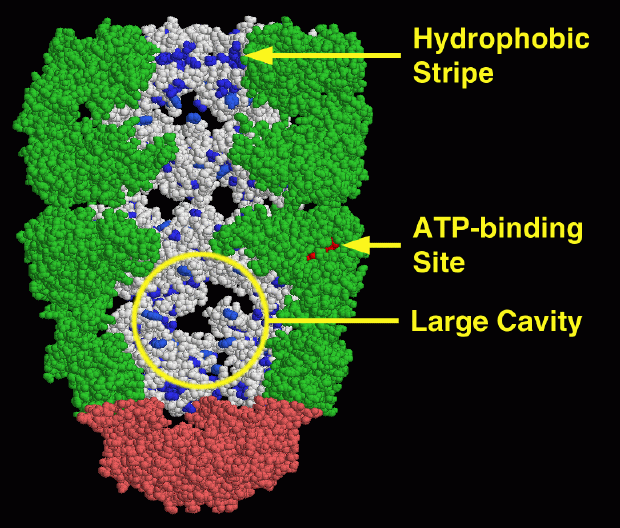
大きなGroEL-GroES複合体をPDBエントリー 1aonで見ることができる。この図では、空洞の内部が見えるように各GroEL環からサブユニットを3つずつ取り除き、残り4つずつを表示している。奥に表示されている2つのサブユニットには、青で示した炭素が豊富なアミノ酸(LEU、ILE、VAL、MET、PHE、TYR)がある。上端の入口付近には、炭素が豊富な「疎水性」(hydrophobic)アミノ酸の縞があることに注意して欲しい。この部分はまだ折りたたまれていないタンパク質を空洞に誘導することで強力に相互作用する。一方、空洞の底はピンク色で示したGroESに覆われている。GroELの環は、ATPのエネルギーを使って大きく形状を変化させる(ここでは赤で示したADPが見える)。それによって空洞はより大きくなり、炭素が豊富なアミノ酸の縞は空洞から隠される。そしてタンパク質鎖(この図には示されていない)が中に取り込まれて自分自身で折りたたみを行う。シャペロンはその折りたたみ過程を行う十分な空間を提供している。
シャペロンについてさらに知りたい方へ
以下の参考文献もご参照ください。
- 2002 Molecular chaperones in the cytosol: from nascent chain to folded protein. Science 295 1852-1858
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









