78: ルシフェラーゼ(Luciferase)
初めて蛍をみた時のことを覚えているだろうか? 田舎に住んでいたなら、子供の頃に蛍を追いかけたことだろう。著者のようにそうでなくても、夏休みに蛍を見つける楽しい経験をしたかもしれない。蛍は暖かい夏の夕暮れの楽しく素晴らしいものの1つである。
輝け小さな光る虫よ、輝け
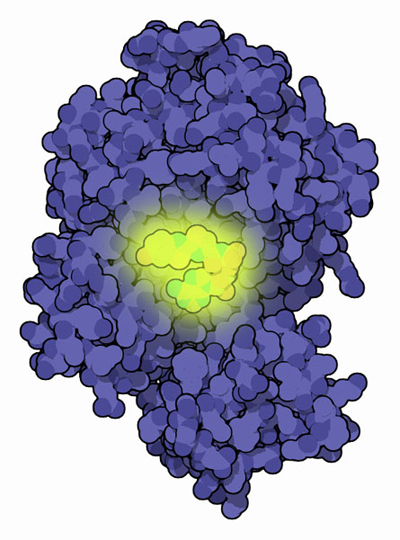
蛍の冷たく黄色っぽい光は、ここに示したルシフェラーゼ(luciferase)酵素(PDBエントリー 2d1s)によって作られる。光を作り出すのは簡単ではない。それにはたくさんのエネルギーが必要で、緑色光の光子1個につき約8個分のATP分子の分解で得られるエネルギーが必要となる。そのため、ルシフェラーゼは光をつくるのに大変強力な過程を使う。ルシフェラーゼはルシフェリン(luciferin)と呼ばれる補因子を持っているが、この補因子は酸素を伴って強くひずんだ複合体を形成する。形成は全てATP分子の助けを借りて行っている。この酸化されたルシフェリンが分解されると、反応過程で二酸化炭素が形成される。そして後に残った、高度に励起された状態のルシフェリンから光が放出される。
道を照らす
ルシフェラーゼの発光反応は自己完結的で必要なものは酸素とATPだけであるため、巧みな研究者はこの反応を科学的研究の道具として使ってきた。この反応は、細胞内でATP量を報告する検出器として使うことができる。もし光れば、その周囲にATPがあるに違いない。ルシフェラーゼは、他のタンパク質にくっつけることで、それが生きた生物のどこにあるのか見るのにも使われている。その光は、個々の細胞を追跡するには暗すぎることが多いが、がん細胞の大きな集まりを標識するのに使われている。光る細胞を見ることで、がんの成長や転移を追跡したり、成長が止まるかどうかを見て新しい抗がん治療の試験をしたりしている。
闇の中で輝く
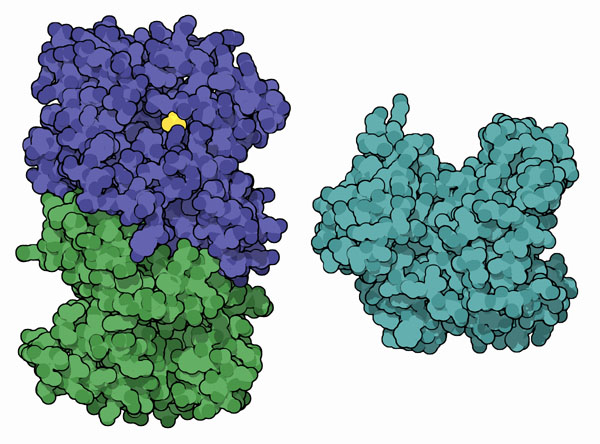
生物進化の過程で、生物発光の化学的な策略が何度も見いだされている。見いだした生物には、細菌、菌類、イソギンチャク、渦鞭毛虫(dinoflagellate)、そしてもちろん蛍がある。いずれの場合にも、酸素を捕獲するのにルシフェリン補因子を使うルシフェラーゼタンパク質がある。ただタンパク質はどれも大きく異なり、ルシフェリンも様々な形や大きさをとっている。これは同じ機能を行うのにそれぞれ別々に進化してきたことを示唆している。ここでは2つの例を示す。左に示すのは細菌のルシフェラーゼ(PDBエントリー 1brl)、右に示すのは砕ける波に見られる緑っぽい光に関わる渦鞭毛虫のルシフェラーゼ(PDBエントリー 1vpr)の構造である。どちらの構造にもルシフェラーゼタンパク質だけが含まれ、ルシフェリン補因子は含まれていないことに注意して欲しい。
遺伝的観点から見た更なる情報を、欧州バイオインフォマティクス研究所の「今月のタンパク質」で見ることができます。
構造を見る
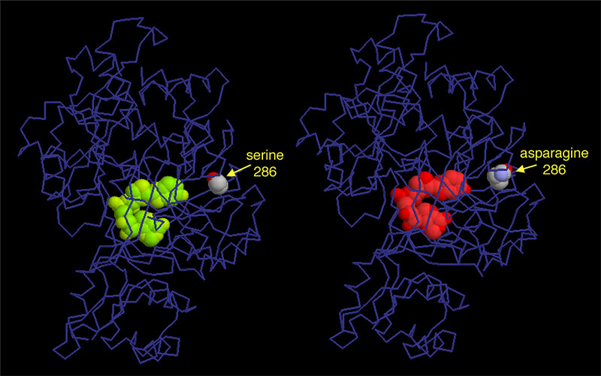
ルシフェラーゼによって放出される光の色は、ルシフェリンを取り囲むアミノ酸に大きく依存している。左に示したPDBエントリー 2d1sは、日本の蛍(ゲンジボタル)から得られたルシフェラーゼの構造である。これは通常黄緑色の光を放出する。ところが、あるアミノ酸をセリンからアスパラギンに変えると、放出される光の色は赤に変わる(右、PDBエントリー 2d1t)。驚くべきことに、この変化した場所はルシフェリンとはかなり離れた場所にあり、色の変化はアミノ酸の包み込み方のわずかな違いと、ルシフェリン周辺の柔軟性の変化によって起きていると考えられている。
"luciferase" のキーワードでPDBエントリーを検索した結果はこちら。
ルシフェラーゼについてさらに知りたい方へ
当記事を作成するに当たって用いた参考文献を以下に示します。
- 1998 Bioluminescence. Annual Review of Cell and Developmental Biology 14 197-230
- 1996 Firefly luciferase: the structure is known, but the mystery remains. Structure 4 223-228
- 2005 Bioluminescence imaging in living organisms. Current Opinion in Biotechnology 16 73-78
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









