56: カスパーゼ(Caspases)
私たちの体内では1時間に何十億個もの細胞が死んでいる。これは全く異常なことではない。ヒトの身体は自分自身で継続的に更新を行っており、使われなくなったり損傷を受けたりした細胞を取り除いて健康な新しい細胞と取り替えている。しかし、この仕事は注意深く行わなければならない。切り傷などで細胞が損傷すると、細胞はふくらんで破裂し周囲を汚染する。身体はこの種の細胞死には厳しく反応し、後片付けをするために殺到した血球によって炎症を起こす。この面倒な問題を避けるため、必要に応じてきれいに素早く死ぬ方法が細胞には仕掛けられている。細胞は信号を受け取ると、内部構造を解体し、隣接する細胞によって速やかに消費される小さく整った小片へと分断する。この制御された、消毒的な死の過程はアポトーシス(apoptosis)と呼ばれる。
どの細胞が死なねばならないのか?
アポトーシスは様々な目的で使われる。胚(embryo)の発生過程では、器官は最初本来よりも大きな構造物として作られ、その後必要ない部分が取り除かれる。例えば、神経系(nervous system)の発生過程において、半分の神経細胞が死ぬことで適切な神経配線が残る。おたまじゃくし(tadpole)が尾を失っていく過程を観察すると、それはアポトーシスが進行しているところを見ていることにもなる。大人なら、体内で使われなくなった細胞を殺して新しい細胞と置き換えるという仕事がアポトーシスによって続けられている。この仕事は特に骨髄(bone marrow)や腸(intestine)といった器官で頻繁に行われている。アポトーシスは放射線(radiation)やウイルス感染(virus infection)によって損傷を受けた細胞から私たちを守っている。このような面倒を起こす細胞は、検出されると速やかに自殺するよう命じられる。アポトーシスはがんに対する主要な防衛策の一つでもあるが、致死的ながん細胞は自身のアポトーシス機械を働かなくする変異をしばしば行っている。
死刑執行人
カスパーゼ(caspase)はアポトーシスにおける死刑執行人とも言える、細胞内で重要なタンパク質を切り刻む蛋白切断酵素である。この名前はこの酵素が持つ2つの性質を表している。まず、切断反応を行うのにシステイン(cysteine)内にある硫黄原子(sulfur atom)を使うシステインタンパク質分解酵素(cystein protease)であるということ、そしてもう一つは、タンパク質鎖中のアスパラギン酸(aspartate)アミノ酸の隣で切断を行うということである。この酵素は見境無く切断する訳ではなく、きちんとした方法で細胞の解体するのに必要とされる正確な切断を行うよう設計されている。
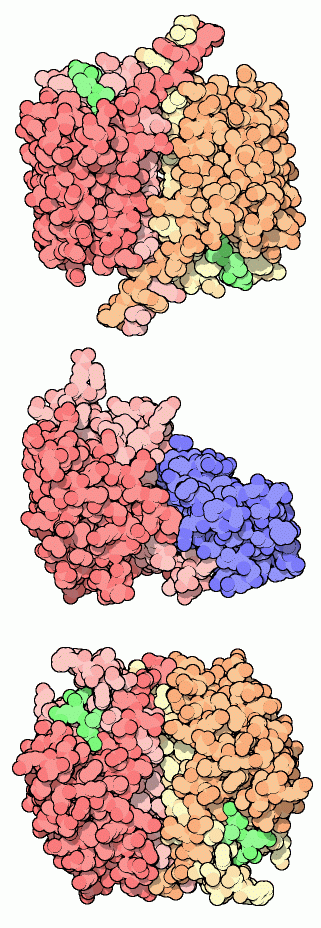
PDBにあるカスパーゼ
ヒトの細胞では12種類近くが発見されており、それぞれが少しずつ異なる役割を担っている。その多くの構造がPDBに登録されていて見ることができる。そのうちの3つをここに示す。カスパーゼ-1(インターロイキン-1β 変換酵素 interleukin-1beta-converting enzyme とも呼ばれる)は最初に発見されたカスパーゼである。これは直接アポトーシスには関わっていないが、白血球(white blood cell、leukocyte)において細胞信号分子(cell signaling molecule)を処理する。他のカスパーゼと同様に、活性型の場合2つの鎖で構成されており、それぞれが2つの断片へと切断される。右図上に示した構造(PDBエントリー 1ice)は2つの活性部位(active site)に小さな阻害剤(inhibitor、緑色)が結合している。右図中央に示したカスパーゼ-9(PDBエントリー 1nw9)は阻害タンパク質(inhibitory protein、青色)に結合している。阻害剤はカスパーゼを不活性型の状態にとどめる。阻害剤が解放されると、他のカスパーゼと連なって、より長い活性のある複合体を形成できるようになる。カスパーゼ-9 はアポトーシス過程を開始するイニシエーターカスパーゼ(initiator caspase)の一つである。このカスパーゼが仕事開始のメッセージを受け取って、活性化状態となり、そして右図下に示したカスパーゼ-3(PDBエントリー 1pau)のようなエフェクターカスパーゼ(effector caspase、アポトーシスの実行に直接的に関わるカスパーゼ)に切断を加える。カスパーゼ-3 は他のエフェクターカスパーゼと一緒になって細胞を解体するという大きな仕事に取りかかる。
なお、遺伝的視点から見たカスパーゼに関する更なる情報が欧州バイオインフォマティクス研究所(EBI)の「今月のタンパク質」に記載されています。
アポトーシスの助手
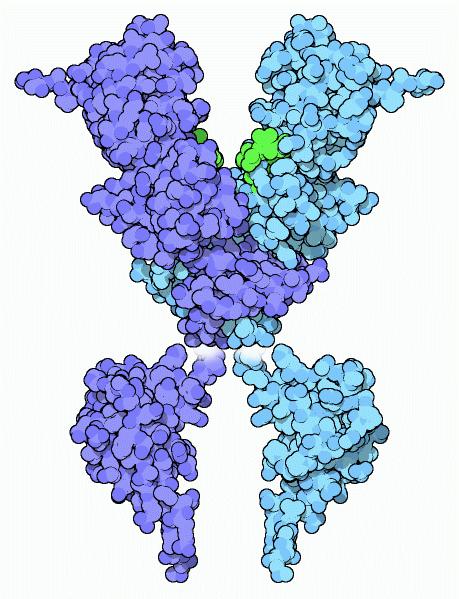
カスパーゼはタンパク質をごく小さな断片へと分解するよう設計されているが、細胞は分解を行うのに他の分子の助けも借りる必要がある。そのため細胞は、分解を助けるたくさんのカスパーゼによって活性化されたタンパク質も持っている。ここに示すのはその一つ、カスパーゼによって活性化されたデオキシリボヌクレアーゼ(deoxyribonuclease、デオキシリボ核酸分解酵素、PDBエントリー 1v0d、1c9f)である。アポトーシスが行われる間、カスパーゼは下にある大きな2つのドメインに結合する阻害タンパク質を分解し、活性型を作り出す。DNAは上にある大きな溝へと入り込み、活性部位のアミノ酸(緑色の部分)がそれを小さな断片へと分解する。
構造をみる
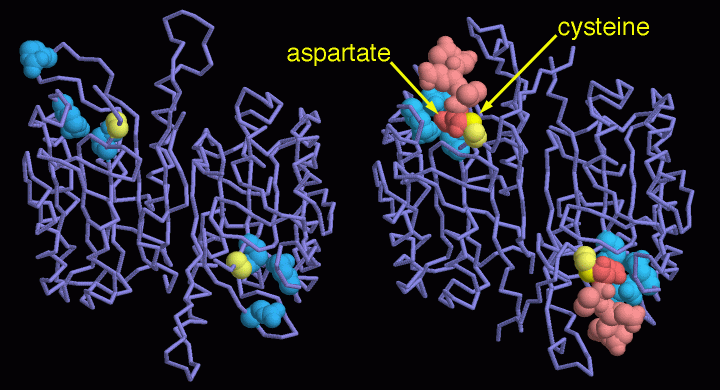
もちろんカスパーゼは周囲にとっては危険な酵素なので、最初は不活性型の酵素前駆体として作られる。上図左の構造(PDBエントリー 1k88)はその一例、カスパーゼ前駆体-7(procaspases-7)を示したものである。活性部位には反応性に富む1つのシステイン(黄色の部分)と、3つの塩基性アミノ酸(2つのアルギニン(arginine)と1つのグルタミン酸(glutamate)、青色の部分)が含まれており、これが切断対象タンパク質中のアスパラギン酸を認識する。図から分かるように、カスパーゼ前駆体は柔軟な状態で、これら4つの重要なアミノ酸は集まらず詰まった活性部位を形成していない。これが活性化されると、タンパク質鎖中に戦略的な切断を加えることによって、活性部位が適切な構成となることができる。上図右に示した構造(PDBエントリー 1f1j)は活性部位に短いタンパク質鎖が結合した活性状態のカスパーゼ-7 である。この構造は反応途中の酵素の状態をとらえたものである。システインが切断対象のタンパク質鎖に結合し、アスパラギン酸を3つの塩基性アミノ酸の内側へ位置させる。
"カスパーゼ" のキーワードでPDBエントリーを検索した結果はこちらで参照できます。
更に知りたい方へ
以下の参考文献もご参照ください。
- 1998 To die or not to die: an overview of apoptosis and its role in disease. Journal of the American Medical Society (JAMA) 279 300-307
- 1997 Caspases: killer proteases. Trends in Biochemical Sciences 22 299-306
- 2000 Insights into programmed cell death through structural biology. Cell 103 273-282
- 2002 Mechanisms of caspase activation and inhibition during apotosis. Molecular Cell 9 459-470
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









