46: トリプシン(Trypsin)
私たちの身体は成長と修復のため安定したアミノ酸の供給を必要とする。通常の大人は体重によって1日35〜90gのタンパク質が必要であるが、かなり驚くべきことにその多くは体内で得られる。通常の北米の食事には1日70〜100gのタンパク質※が含まれているが、一方で、私たちの身体は消化を助け役目を終えると自分自身を消化するタンパク質を20〜30g分泌している。血管に漏れ出す死んだ腸細胞やタンパク質も消化され、アミノ酸となって再び吸収される。このことは私たちの身体が再利用の達人であることを示している。
日本の場合1人1日当たりの供給量は82.3g(農林水産省食糧需給表2007年概算値)。
タンパク質のはさみ
タンパク質は丈夫なので、私たちはタンパク質をその構成単位であるアミノ酸にまで消化するのにいくつもの酵素を使っている。タンパク質の消化は胃で始まる。ここでは塩酸(hydrochloric acid)がタンパク質を変性させ、それを酵素のペプシン(pepsin)が大雑把に分解する。そして実質的な消化は腸(intestine)で始まる。膵臓(すい臓、pancreas)はタンパク質を切断する酵素の集まりを加える。ここではトリプシン(trypsin)が中心的な役割を果たし、タンパク質鎖を切り刻んで数個の長さのアミノ酸鎖にする。そしてその断片は、腸細胞の表面と内側にある酵素によって個々のアミノ酸にまで切断され、身体全体で使える状態になる。
タンパク質切断機械
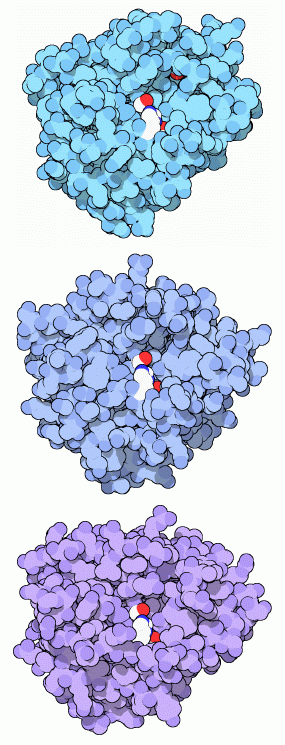
トリプシンはタンパク質切断反応において特別なセリン(serine)アミノ酸を用いることから、セリンプロテアーゼ(serine protease)として知られている。セリンプロテアーゼはさまざまな酵素が集まったファミリーで、どれも似た酵素の機械を使っている。消化では、トリプシン、キモトリプシン(chymotrypsin)、エラスターゼ(elastase)は協同して働き、タンパク質を切断する。それぞれ特有のタンパク質鎖を対象とする。トリプシン(図上、PDBエントリー 2ptn)はリジン(lysine)とアルギニン(arginine)の隣を切断する。キモトリプシン(図中央、PDBエントリー 2cha)はフェニルアラニン(phenylalanine)などの大きなアミノ酸の隣を切断する。エラスターゼ(図下、PDBエントリー 3est)はアラニン(alanine)のように小さなアミノ酸でできたペプチド鎖がお好みである。各図では重要なセリンを中央に赤色で示す。これにはヒスチジン(histidine、白と青)とアスパラギン酸(aspartate、赤で示した酸素1個だけが見えている)を伴っている。トリプシンに似た酵素は体内の他の場所でも見つかる。この中には高い特異性があり、特定に対象タンパク質だけを切断するものもある。例えば、今月の分子で2002年1月に紹介したトロンビン(thronbin)は、血栓(blood clot)を作るフィブリノーゲン(fibrinogen)を特異的に切断するよう設計されている。
丈夫な酵素
セリンプロテアーゼは酵素の発見と研究において中心的な役割を果たしている。その理由の一つは、研究しやすいからである。消化液中に豊富に含まれていて大変溶けやすいので、集めて精製するのが比較的容易なのである。また機能を研究するのも簡単である。あるタンパク質を投げ込み、どれだけ速く消化されるかを見るだけでよいからである。キモトリプシンはX線結晶学で研究された最初のタンパク質の一つで、その研究によりこれが対象タンパク質をつかんで正確な原子変化を行う複雑な機械であることが明らかになった。今日、何百個ものセリンプロテアーゼの構造がPDBデータバンクに登録され、探索されるのを待っている。
タンパク質分解酵素の危険
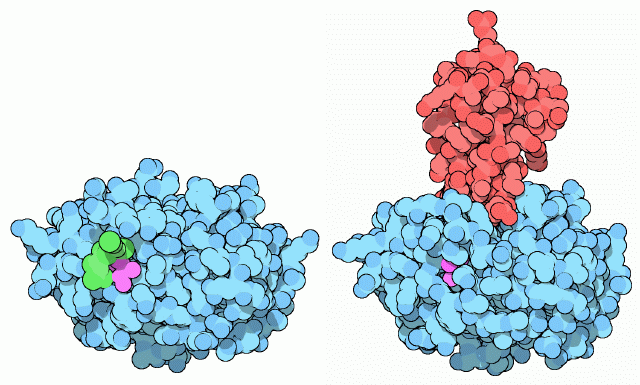
体内にあるタンパク質の消化は細心の注意を要する仕事である、と思うかもしれない。タンパク質は各細胞において材料の5分の1を作り出している。そのため、タンパク質切断機械を作る時には注意しなければならない。消化酵素にとって、その方策とは酵素を不活性な型(これを酵素前駆体(zymogen、チモーゲン)と呼ぶ)で作っておき、その後腸内で活性化するというものである。トリプシンは最初余分なタンパク質鎖をつけて作られる。それが上図左の構造(PDBエントリー 1tgs)中にある緑色の部分である。実際、この結晶構造ではこの余分な部分のうち2個のアミノ酸しか見えていないので、タンパク質から離れて辺りをばたばたしている残りの部分を想像しなくてはならない。この余分な部分がついた型のトリプシンはトリプシノーゲン(trypsinogen)と呼ばれる不活性型で、タンパク質鎖を切断することはできない。これが腸に入ると、エンテロペプチダーゼ(enteropeptidase)酵素によって小さな尾部が切断される。これによって新たにできる鎖の末端(赤紫の部分)が折りたたまれたタンパク質の中にしまいこまれて安定化し、右側に示した活性型の酵素(PDBエントリー 2ptc)になる。更に保険として、膵臓も小さなタンパク質トリプシン阻害剤(図右の赤色部分)を作る。これは腸に分泌される前に存在するどんな微量の活性型トリプシンでも結合して活性を阻止する。これはトリプシンの活性部位に結合して、その活性を阻害するがこの阻害剤自体は小片へと切断されることはない。
構造をみる
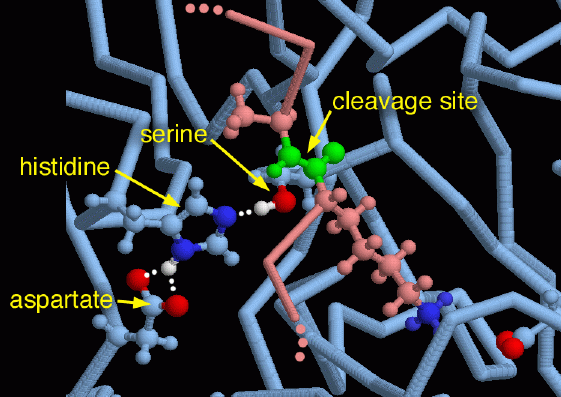
PDBデータベースを見ると、消化、ホルモン活性化、血液凝固、免疫機構活性化などさまざまな機能のために作られるセリンプロテアーゼの事例を見いだすことができるだろう。それらはタンパク質切断反応を補助するための独特なアミノ酸の集まりを共有している。これは進化によって繰り返し発見されてきたものである。機械の中心はヒスチジンとアルパラギン酸によって活性化されるセリンアミノ酸である。これら3つのアミノ酸をまとめて、電荷中継機構(charge relay system)と呼ばれている。ヒスチジンとアスパラギン酸はセリンの水素原子(白)を除去するのを助ける。これによって切断対象のタンパク質を攻撃する際の活性が更に上がる。右に示した図はPDBエントリー 2ptcの構造データを用いて作ったもので、阻害剤タンパク質(ピンク)がトリプシンの活性部位に結合している様子が描かれている。緑色で示した阻害剤の切断部位は、この位置ではほとんどのタンパク質は切断されないという十分離れた場所で捕まえられている。右下に伸びている長いリジンアミノ酸にも注目して欲しい。これはトリプシンの中にある別のアスパラギン酸と相互作用する(そのアスパラギン酸の酸素原子が図の右下の角に赤色で示されている)。トリプシンは、この反応によってリジンアミノ酸かアルギニンアミノ酸の隣を好んで切断する。
"トリプシン" のキーワードでPDBエントリーを検索した結果はこちらで参照できる。また、遺伝的視点から見たトリプシンに関する追加情報が、欧州バイオインフォマティクス研究所(EBI)の「今月のタンパク質」で提供されている。
トリプシンについてさらに知りたい方へ
以下の参考文献もご参照ください。
- 1974 A family of protein-cutting proteins. Scientific American 231 74-88
- 1990 Digestion and absorption of dietary protein. Annual Review of Medicine 41 133-139
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









