239: ホスホリパーゼA2(Phospholipase A2)
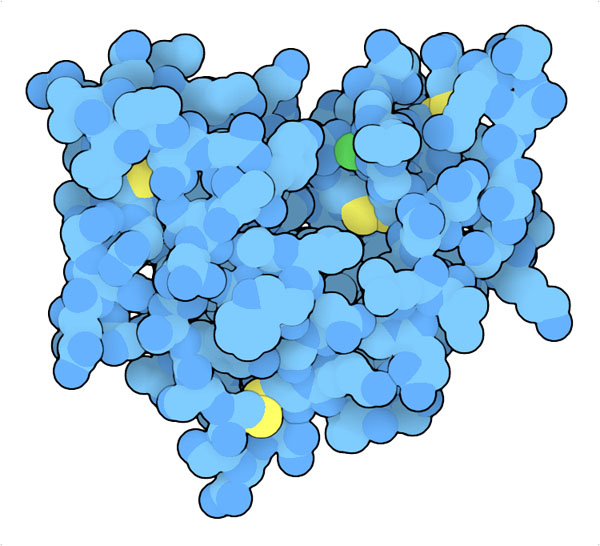
100年以上前、ヘビの毒に含まれる酵素は細胞膜中の脂質分子を分解するということが明らかになった。それ以降、さまざまな場所でこれと似た酵素が見つかってきた。消化のため
小さくて丈夫
ヘビ毒のホスホリパーゼと
炎症反応
ホスホリパーゼA2によって放出される脂質の末端部の中には、炎症や痛みに関わる信号分子をつくるのに使われるものもある。この作用のため、ホスホリパーゼの働きに不具合があるとアテローム性動脈硬化(atherosclerosis)やクローン病(Crohn’s disease)などの重い病気につながる可能性がある。現在、この酵素の働きを妨げることによりこれらの病気を治す新たな薬を見つけるのにホスホリパーゼの構造が利用されている。
内側と外
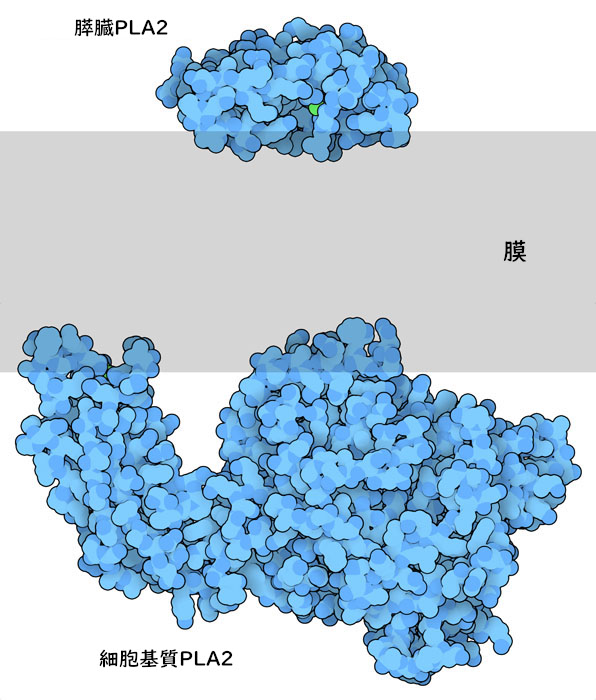
さまざまな型のホスホリパーゼA2が異なる目的のためにつくられている。分泌されるホスホリパーゼA2は小さいのに対し、細胞基質にある酵素はこれより大きく、膜との相互作用に関わるドメインと切断反応を触媒するドメインに分かれている(ここに示すのはPDBエントリー1cjy)。これらすべての酵素は表面に膜の表面と相互作用する領域を持ち、酵素が切断対象とする脂質を引き出せるようになっている。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
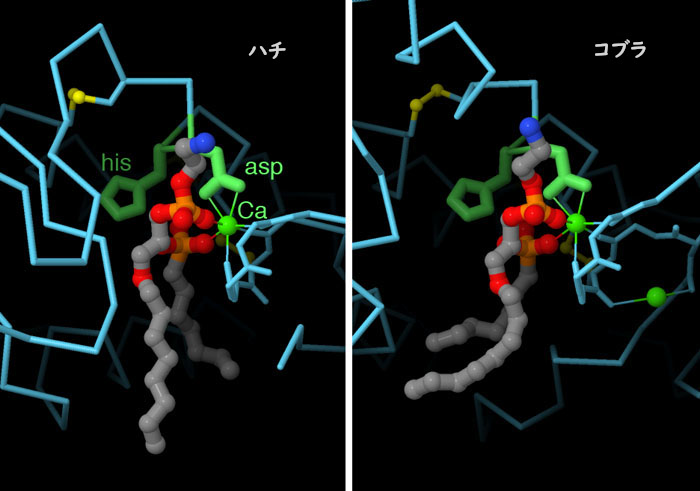
ここに毒素由来ホスホリパーゼを二種類示す。一方はハチの毒由来(PDBエントリー1poc)で、もう一方はコブラの毒由来(1pob)のものである。これら酵素の構造は大きく違っているが、活性部位にあるアミノ酸は非常によく似ている。このアミノ酸には、切断対象となる脂質の結合を攻撃するヒスチジンや、カルシウムイオンを配位させるアスパラギン酸が含まれる。これらの構造はいずれも活性部位にリン脂質類似物質が結合していて、異なる二つの酵素が反応を行うすべての準備をどのようにして行っているのかを示している。図の下のボタンをクリックして対話的操作のできる画像に切り替えると構造をより詳しくみることができる。
理解を深めるためのトピックス
参考文献
- 2011 Phospholipase A2 enzymes: physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chem. Rev. 111 6130-6185
- 1c1j 1999 Structure of Cadmium-substituted Phospholipase A2 from Agkistrodon halys Pallas at 2.8 Angstroms Resolution. Protein Pept. Lett. 6 185-193
- 1pob、1poc 1990 Crystal structure of bee-venom phospholipase A2 in a complex with a transition-state analogue. Science 250 1563-1566
- 1bp2 1981 Structure of bovine pancreatic phospholipase A2 at 1.7A resolution. J. Mol. Biol. 147 97-123
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









