202: ジペプチジルペプチダーゼ4(Dipeptidyl Peptidase 4)
私たちの体はどのようにして完全なバランスを保ち、各細胞が必要な資源を確保できるようにしているのか不思議に思ったことはないだろうか? 恒常性(homeostasis)と呼ばれるこのバランスは、体の異なる部分にある細胞が互いに継続的なやりとりを行い、協力し合うことによって達成されている。例えば、全ての細胞はエネルギー源としてブドウ糖(glucose)が必要だが、ホルモンの複雑なネットワークによって必要な場所にブドウ糖が届くようにしている。私たちが何かを食べる時、消化系細胞はインクレチン(incretin)というホルモンを分泌し、ブドウ糖がこれから利用できることを体に知らせる。このホルモンは
ジペプチジルペプチダーゼ4(DPP4)
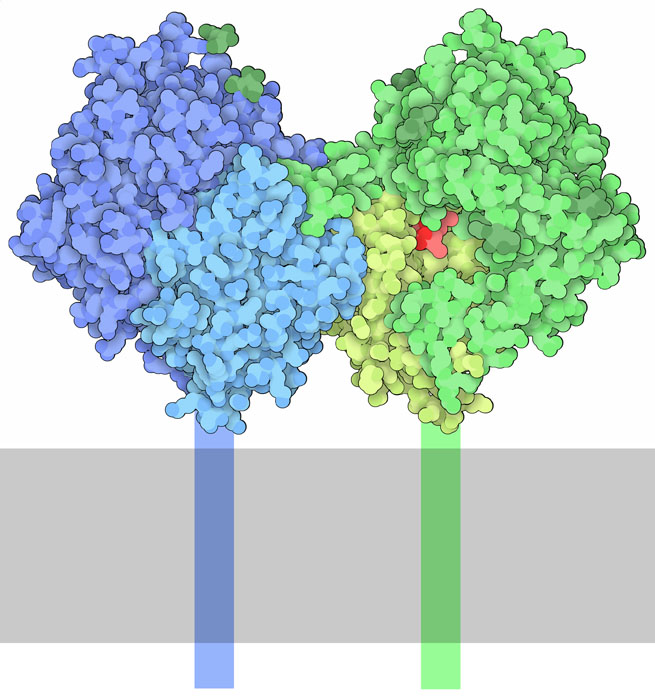
ホルモンはその時々に応じて必要な体の機能を調整しているので、ホルモンによる信号は環境変化に応じて注意深く制御しておく必要がある。CD26とも呼ばれるジペプチジルペプチダーゼ4(DPP4、dipeptidyl peptidase 4、PDBエントリー1nu8)がこの制御を担っている。膜結合タンパク質で、同じサブユニットが2つ集まり2量体となって働く。体中の細胞表面でみられ、他のさまざまなタンパク質と相互作用して、細胞信号伝達や炎症などの過程において重要な役割を果たしている。またインクレチン(incretin)などいくつかのホルモンの末端から2つのアミノ酸を除去して不活性化する。DPP4は非常にたくさんあるので、インクレチンが体内を循環するのは不活性化される前の数分間だけである。このため、腸にあるインクレチンをつくる細胞と
ペプチドの切り出し
DPP4は、ホルモン分子を構成するペプチド鎖の一端から2番目にあるプロリンまたはアラニンの場所でアミド結合を切断する。切断反応は触媒作用を持つ3つ組のアミノ酸によって行われる。これはトリプシンやエラスターゼのようなセリンプロテアーゼと非常によく似ている。セリンがこの切断反応を行うが、近くにあるヒスチジンとアスパラギン酸によりさらに化学的に活性のある状態となる。酸性のグルタミン酸が2つあって、これが自由な状態になっているホルモン分子のアミノ末端に強く固定されることにより反応を助けている。DPP4はプロリンの隣で切断できる数少ない酵素の一つであるが、これができるのはプロリンが活性部位の疎水性ポケットの中にしっかりはまるからである。DPP4とその基質となるホルモンとの相互作用を理解することは、DPP4の阻害剤開発の基礎になる。
DPP4の基質
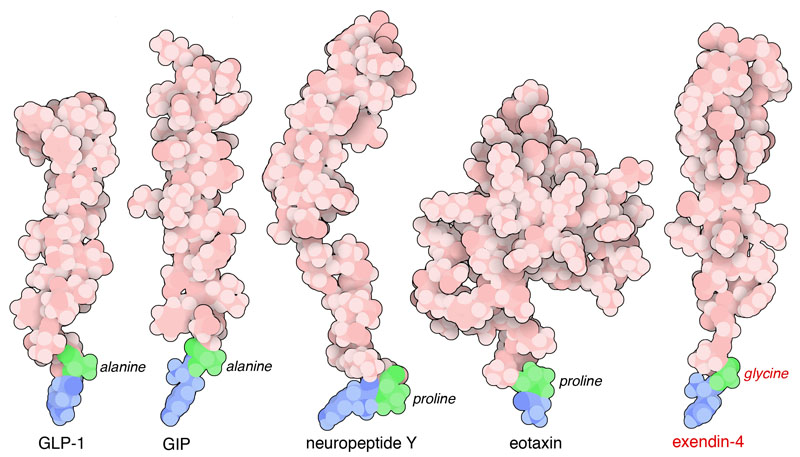
DPP4はインクレチン、神経ペプチドY(neuropeptide Y、PDBエントリー1ron)、ケモカイン(chemokine、炎症性細胞遊走因子)の一種エオタキシン(eotaxin、PDBエントリー1eot)などのペプチドホルモンを分解し、ホルモンが必要な時にだけ活性状態になるようにしている。これらホルモンはいずれも似た共通の構造を持っていて、2番目のアミノ酸はプロリンかアラニンになっている。2つのインクレチンホルモン、グルカゴン様ペプチド1(GLP-1、PDBエントリー1d0r)とブドウ糖依存性インスリン分泌性ポリペプチド(GIP、PDBエントリー2b4n)は特に興味深い。なぜならこれらのペプチドを使って2型糖尿病を治療できるからである。
2型糖尿病の治療
糖尿病患者はインスリンの分泌が少ないので血液中のブドウ糖濃度が危険なレベルにまで上昇している。治療する一つの方法はDPP4を阻害することである。そうすればインクレチンはより長く作用し、インスリンをつくるよう刺激することができる。これを行う上で2つの方法がとられた。まず、DPP4が分解できないようなGLP-1やGIPの類似物質が開発された。例えば、エクセナチド(exenatide)という薬は、アメリカドクトカゲ(Gila monster)の毒から見つかった天然のインクレチン類似物質エキセンジン-4(exendin-4、PDBエントリー1jrj)から開発された。これらの分子は血液中をより長く循環し、より多くのインスリンを分泌を促し、糖尿病状態にある血糖値を下げるのに貢献する。ただ残念なことに、このインクレチン類似物質は通常小さなタンパク質であり、注射による投与が必要である。もう一つの方法は口から摂取できる薬を使って直接DPP4の作用を阻害し、天然のインクレチンがより長く血液中を循環することができるようにするというものである。
構造をみる
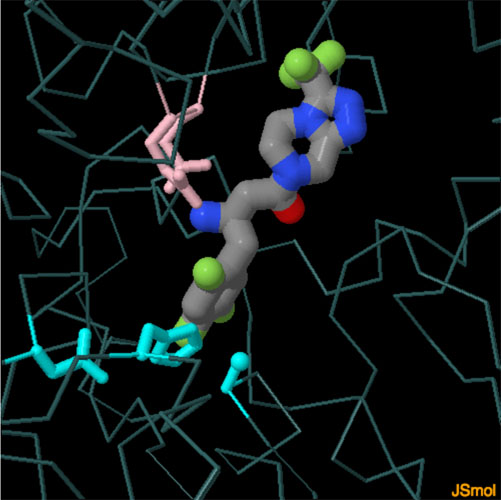
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
2006年、アメリカ食品医薬品局(Federal Drug Administration)は最初のDPP4阻害剤としてシタグリプチン(sitagliptin、PDBエントリー1x70)を承認した。その後すぐに、さまざまな他の抗糖尿病薬もつくられ、これらはまとめてグリプチン系と呼ばれている。これらの薬はいずれもインクレチンホルモンの末端をまねた構造を持っていて、DPP4の活性部位を阻害するのでホルモンを不活性化できなくなる。図の下のボタンをクリックして対話的操作のできる画像に切り替えると、6種類のグリプチンとDPP4基質類似物質の一つをみることができる。
理解を深めるためのトピックス
- DPP4によって切断される他のホルモンの構造もPDBに登録されている。その中に、ペプチドYY(PDBエントリー2dez)やケモカインRANTES(PDBエントリー1rtn)などがある。これらをみて、DPP4によって切り離されたジペプチドを見つけてみよう。
- RCSB PDBが提供するProtein Feature ViewのDPP4ページで、構造に含まれていない酵素部分を見ることができる。
参考文献
- 2015 DPP4 in diabetes. Frontiers in Immunology 6 386
- 3w2t 2013 A comparative study of the binding modes of recently launched dipeptidyl peptidase IV inhibitors in the active site. iochemical and Biophysical Research Communications 434 191-196
- 2013 An emerging role of dipeptidyl peptidase 4 (DPP4) beyond glucose control: potential implications in cardiovascular disease. Atherosclerosis 226 305-314
- 3vjk 2012 Discover and preclinical trials of teneligliptin (3-[(2S,4S)-4-[4-(3-methyl-1-phenyl-1H-pyrazol-5-yl)piperazin-1-yl]pyrrolidin-2-ylcarbonyl]thiazolidine): a highly potent, selective, long-lasting and orally active dipeptidyl peptidase IV inhibitor for the treatment of type 2 diabetes. Bioorganic and Medicinal Chemistry 20 5705-5719
- 3g0b 2011 Design and synthesis of pyrimidinone and pyrimidinedione inhibitors of dipeptidyl peptidase IV. Journal of Medicinal Chemistry 54 510-524
- 3bjm 2008 Involvement of DPP-IV catalytic residues in enzyme-saxaglyptin complex formation. Protein Science 17 240-250
- 2rgu 2007 8-(3-(R)-aminopiperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methyl-quinazolin-2-ylmethyl)-3,7-dihydropurine-2,6-dione (BI 1356), a highly potent, selective, long-lasting, and orally bioavailable DPP-4 inhibitor for the treatment of type 2 diabetes. Journal of Medicinal Chemistry 50 6450-6453
- 2b4n 2006 NMR and alanine scan studies of glucose-dependent insulinotropic peptide in water. Journal of Biological Chemistry 281 16370-16376
- 1x70 2005 (2R)-4-oxo-4-[3-(trifluoromethyl)-5,6-dihydro[1,2,4]triazolo[4,3-a]pyrazin-7(8H)-yl]-1-(2,4,5-trifluorophenyl)butan-2-amine: a potent, orally active dipeptidyl peptidase IV inhibitor for the treatment of type 2 diabetes. Journal of Medicinal Chemistry 48 141-151
- 1nu8 2003 Structural basis of proline-specific exopeptidase activity as observed in human dipeptidyl peptidase-IV. Structure 11 947-959
- 1d0r 2001 Structure and folding of glucagon-like peptide-1-(7-36)-amide in trifluoroethanol studied by NMR. Magnetic Resonance Chemistry 39 477-483
- 1jrj 2001 Exendin-4 and glucagon-like-peptide-1: NMR structural comparisons in the solution and micelle-associated states. Biochemistry 40 13188-13200
- 1eot 1998 Solution structure of eotaxin, a chemokine that selectively recruits eosinophils in allergic inflammation. Journal of Biological Chemistry 273 22471-22479
- 1ron 1996 Solution structure of human neuropeptide Y. Journal of Biomolecular NMR 8 379-390
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









