190: 2つの要素で構成される検知・応答系(Two-component Systems)
細菌は私たちよりもずっと強い影響を環境から受けて生きている。私たちの体は温度や資源の変化を和らげてくれ、環境が本当に悪くなればいつでもそこから立ち去ることができる。一方細菌ではそのようにはいかない。細菌は小さくて、細菌の周辺環境が大きく変化してもそれに従わざるを得ず、しばしば手持ちの材料でそれに対処しなくてはならない。このため、細菌は周辺の環境条件を調べるセンサー群を作り、どのように応答するのが最も良いのかを判断している。
2つの構成要素を使った信号伝達
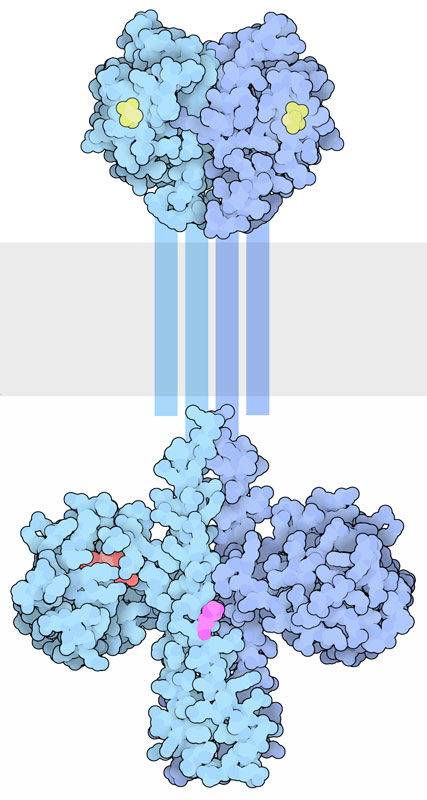
多くの場合、この環境検知系は極めて単純で、たった2つの構成要素からできている。 1つは検知を担う大きな分子で、対象物を検知するセンサードメインが含まれる。例えば、ここに示す分子(PDBエントリー3by8)はクエン酸(citrate)などの小分子の栄養分を検知する。このセンサードメインは、タンパク質の中心付近にある特別なヒスチジンをリン酸化するキナーゼドメイン(kinase domain、PDBエントリー2c2a)とつながっている。このリン酸基はもう1つの構成要素が持つアスパラギン酸(aspartate)に渡される。その2つ目の要素は応答制御因子(response regulator)と呼ばれ、細胞内でしかるべき活動を始動させる。センサーが活性化されると、分子を介してキナーゼドメインに信号が送られる。そして応答制御因子のリン酸化レベルを上げ下げして適応応答を制御する。
テーマに応じた変異
細菌が持つ2つの要素で構成される検知・応答系(two-component system)を見ると、様々な種類があることが分かる。いずれも似た構成要素を組み合わせて作られている。構成要素となっているのは、外部の情報を検知して内部に伝える部分、それに応じた応答を外に返す部分、そしてその両者をつなぐリン酸化機械部分である。但し、細かいところは用途に応じて変化することがよくある。例えば、全体が細胞内にあるものもあれば、センサー部分が細胞外に出ているものもある。細胞全体に信号を伝える応答制御因子が分かれているものもあれば、センサー部分のタンパク質鎖に含まれているものもある。センサーとキナーゼが通信する仕組みについてはまだ分からない部分がたくさんあって、現在も精力的に研究が進められているところである。はさみで切るような動きによって分子を伝えていくという説もあれば、ピストンのような動きをするという説もある。
制御応答
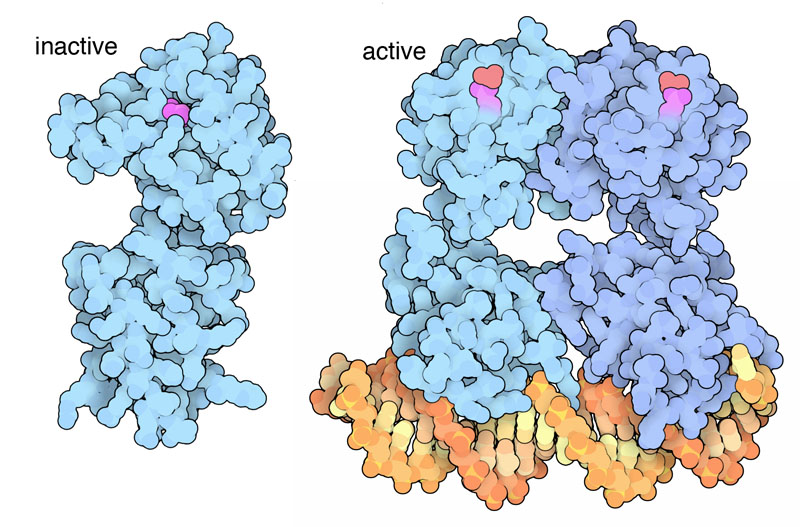
応答制御因子は信号を受け取ると、その情報を細胞内に伝える。多くの場合、応答制御因子はDNAに結合するタンパク質である。リン酸が付加されると、このタンパク質はDNAへの結合を強め、応答に適した遺伝子の転写の程度を調整する。例えば、PDBエントリー1kgsはリン酸化される前の不活性状態の構造を示したものである。一方、PDBエントリー1gxpと1zesはこれと似た制御因子で、活性状態にありDNAに結合している。別の制御分子は、RNAに結合する、酵素として働く、その他のタンパク質に結合するなどかなり違った働きをするが、いずれも最も良い応答を促すのに必要なものである。
構造をみる
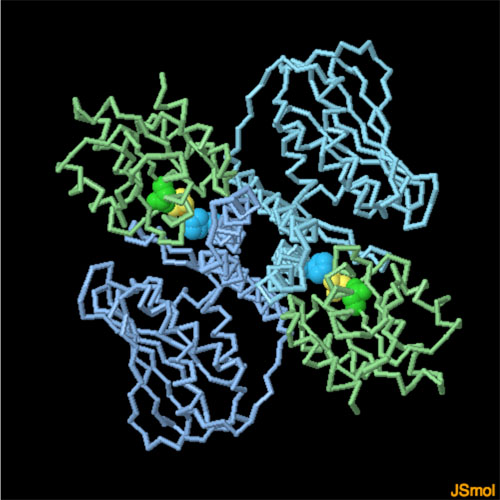
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
PDBエントリー3dgeは、センサータンパク質から応答制御因子に信号を受け渡すところをとらえている。2分子の応答制御因子(緑)と2分子のセンサータンパク質(青)が結合し、応答制御因子の中にある重要なアスパラギン酸とセンサータンパク質の中にある重要なヒスチジンが近くに来るよう配置されている(2つの重要なアミノ酸は球で表示されている)。この構造には硫酸イオン(黄)も含まれているが、本来この場所は輸送されてきたリン酸が来るおおよその位置となっている。図の下のボタンをクリックして対話的操作のできる図に切り替え、より詳しく見てみて欲しい。
理解を深めるためのトピックス
- センサータンパク質は非常に活動的で、対象としている分子を検知すると曲がって、キナーゼドメインがヒスチジンをリン酸化できるようにしています。PDBエントリー4bivの構造はこの過程をとらえています。A鎖には不活性状態のキナーゼがあり、B鎖のキナーゼドメインはHis248(248番のヒスチジン)のすぐそばにあってヒスチジンをリン酸化しようとしています。
- 2つの要素で構成される検知・応答系のタンパク質は組み立て式の構造になっているので、原子構造を決める際に分子を分割することがよくあります。RCSB PDBのProtein Feature Viewで、その分割された断片がタンパク質の配列全体のどの部分に当たるのかを見ることができます。例えば、応答制御タンパク質PhoBのページを見てみてください。
参考文献
- 2010 Molecular strategies for phosphorylation-mediated regulation of response regulator activity. Current Opinion in Microbiology 13 160-167 DOI:10.1016/j.mib.2009.12.009 PMID:20080056 PMC:PMC2859964
- 2010 Bacterial sensor kinases: diversity in the recognition of environmental signals. Annual Review of Microbiology 64 539-559 DOI:10.1146/annurev.micro.112408.134054 PMID:20825354
- 3dge 2009 Structural insight into partner specificity and phosphoryl transfer in two-component signal transduction. Cell 139 325-336 DOI:10.1016/j.cell.2009.08.032 PMID:19800110
- 2009 Biological insights from structures of two-component proteins. Annual Review of Microbiology 63 133-154 DOI:10.1146/annurev.micro.091208.073214 PMID:19575571 PMC:PMC3645274
- 3by8 2008 Crystal structures of C4-dicarboxylate ligand complexes with sensor domains of histidine kinases DcuS and DctB. Journal of Biological Chemistry 283 30256-30265 DOI:10.1074/jbc.M805253200 PMID:18701447 PMC:PMC2573060
- 1zes 2005 Mechanism of activation for transcription factor PhoB suggested by different modes of dimerization in the inactive and active states. Structure 13 1353-1363 DOI:10.1016/j.str.2005.06.006 PMID:16154092 PMC:PMC3685586
- 2c2a 2005 Structure of the entire cytoplasmic portion of a sensor histidine-kinase protein. EMBO Journal 24 4247-4259 DOI:10.1038/sj.emboj.7600886 PMID:16319927 PMC:PMC1356327
- 1gxp 2002 Tandem DNA recognition by PhoB, a two-component signal transduction transcriptional activator. Structure 10 701-713 DOI:10.1016/S0969-2126(02)00761-X PMID:12015152
- 1kgs 2002 Evidence of intradomain and interdomain flexibility in an OmpR/PhoB homolog from Thermotoga maritima. Structure 10 153-164 DOI:10.1016/S0969-2126(01)00706-7 PMID:11839301
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









