183: フォトトロピン(Phototropin)
植物は光に反応し、光に向かって生長したり強すぎる光から身を守ったりすることは昔から知られている。そして多くの場合、植物は青色光の強さに反応する。青色光は他の色の光に比べいくつかの利点がある。可視光の中では最もエネルギーが高いので、光を吸収する発色団分子に対しより大きな影響を与えることができる。また水中に生える植物にとって、青色光は他の色よりも深くまで届くという点でも有利である。植物は他種の生物と同じく、光検知タンパク質を使って青色光の強さを判別し、それに反応している。
光を見る
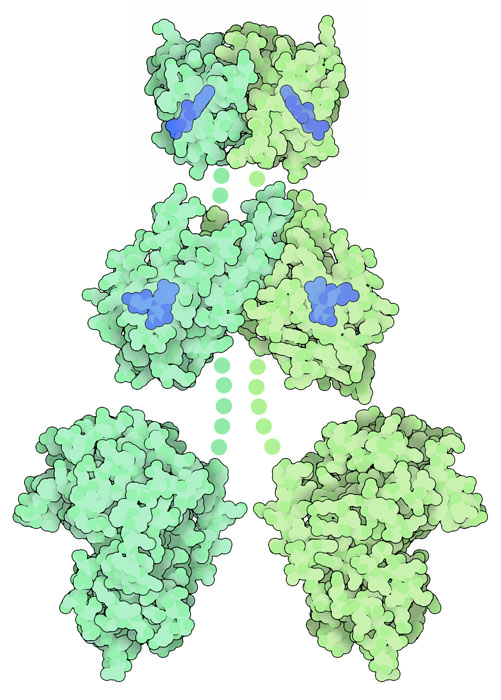
ここに示す光検知タンパク質は、様々な種類の植物から見つかっているフォトトロピン(phototropin)である。葉緑体が最適な位置に来るよう配置を変えたり、葉を広げたりするなど光合成の効率を最大化する応答は重要である。フォトトロピンはいくつかのドメインからできているが、このうちの2つは「LOV(Light, Oxygen, or Voltage の略)ドメインと呼ばれており、青色光を吸収するフラビン発色団(flavin chromophore、青色部分)が中に含まれている。LOVドメインが活性化されるとつながっているセリン-スレオニンキナーゼ(serine-threonine kinase)によってその信号は伝えられる。まだタンパク質全体の構造は得られていないので、ここに示す図はPDBエントリー 2z6c、4hhdに登録されているLOVドメインの構造と、キナーゼドメインに似た別のキナーゼ 1atpを利用し設計された構造から作成した。
LOVで作る
光を検知するLOVドメインはまさにうってつけの構成部品で、他のタンパク質に付加する、吸収する光の調整が行うなどいくつかの方法で改変を加えられてきた。例えば、LOVドメインに異なる種類の検知キナーゼを融合して作られた改変版光センサー(PDBエントリー 4gcz)や、生きた細胞内で分子を標識する用途を想定して蛍光能力を向上させたLOVドメイン(PDBエントリー 4eeu)がPDBに登録されている。
信号を送る
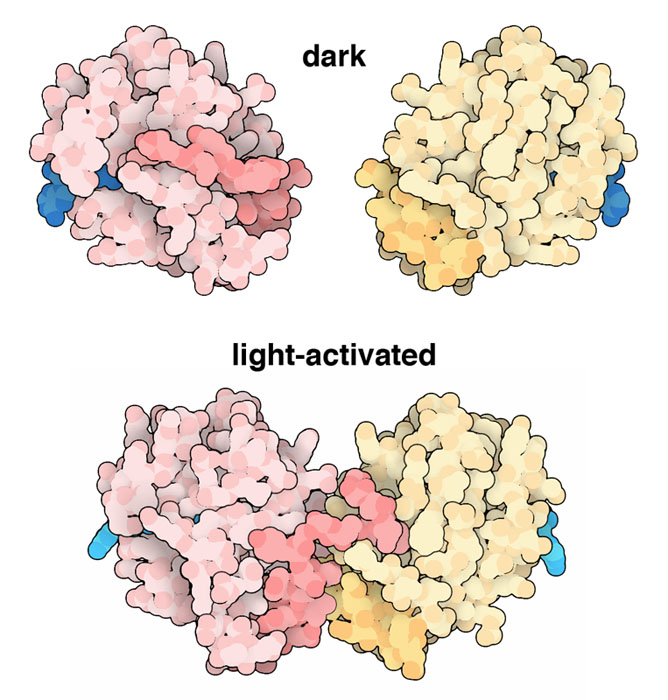
フラビン発色団が光を吸収すると周囲にあるタンパク質が信号を受け取って中継し、最終的には植物の応答を変化させる。フォトトロピンの場合、信号はキナーゼドメインを通る。これが更に細胞内にある他の信号伝達タンパク質を変化させる。詳しいところはまだ研究途上だが、菌類で見つかっている青色光検知タンパク質Vividにおいて、信号伝達過程に関するいくつかの手がかりが見えてきた。このタンパク質はフォトトロピンよりも単純で、LOVドメインを1つしか持たない。暗い状態(PDBエントリー 2pd7)では単量体で存在するが、発色団が光を吸収するとタンパク質表面にあるαらせん(濃い色で示す部分)の配置変化が起こり2量体となる(PDBエントリー 3rh8)。
構造をみる
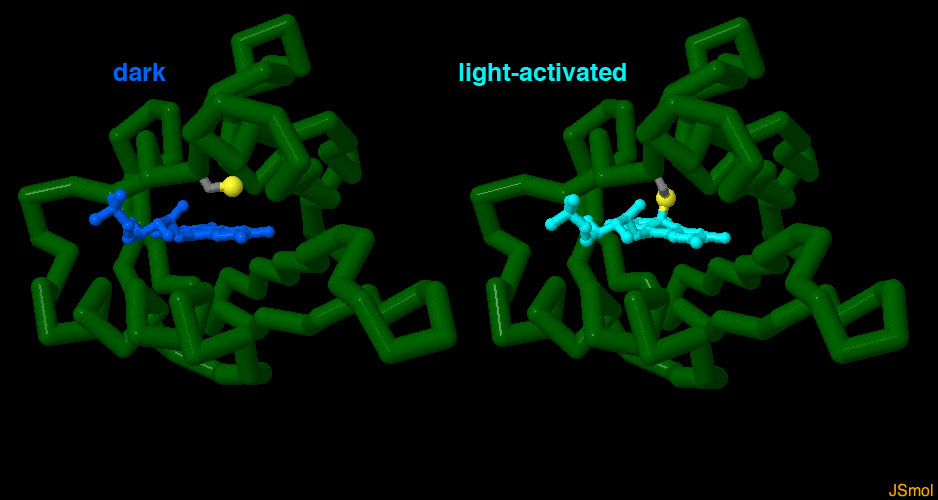
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
フォトトロピンのLOVドメインについても、他の青色光検知タンパク質と同様に、暗状態と光を吸収した状態の両構造が解かれている。フォトトロピンでは、光により活性化されるフラビンが近くにあるシステインアミノ酸に作用し、共有結合を形成する。これによりフラビン分子内にある環状部分と、これを取り囲むタンパク質に歪みが生じる。PDBには2種類の構造(PDBエントリー 1g28、1jnu)が登録されている。図の下のボタンをクリックして対話的操作のできる画像に切り替え、両者を見比べてみて欲しい。
理解を深めるためのトピックス
- 青色光を検知するタンパク質は他にもたくさんあります。フォトトロピンに似た他のタンパク質を見るには、「LOV」のキーワードでPDBエントリーを検索してみてください。また光検知に関係する他の種類のタンパク質を見るには、「cryptochrome」や「BLUF」のキーワードで検索してみてください。
- フラビンは多くの酵素反応において、電子を運ぶ補因子としても用いられています。PDBに登録されているそのような事例を探すには、「FAD」のキーワードで検索してみてください。
- RCSB PDBの「Protein Feature View」を使うと、フォトトロピンを構成する各ドメインがどのようにして集まっているのかについて見ることができます。例:シロイヌナズナのフォトトロピン
参考文献
- 2014 Photochemistry of flavoprotein light sensors. Nature Chemical Biology 10 801-809 DOI:10.1038/nchembio.1633
- 4gcz 2013 Full-length structure of a sensor histidine kinase pinpoints coaxial coiled coils as signal transducers and modulators. Structure 21 1127-1136 DOI:10.1016/j.str.2013.04.024
- 4hhd 2013 Coiled-coil dimerization of the LOV2 domain of the blue-light photoreceptor phototropin 1 from Arabidopsis thaliana. Acta Crystallographica F69 1316-1321 DOI:10.1107/S1744309113029199
- 4eeu 2012 Structural tuning of the fluorescent protein iLOV for improved photostability. Journal of Biological Chemistry 287 22295-22304 DOI:10.1074/jbc.M111.318881
- 2011 Old chromophores, new photoactivation paradigms, trendy applications: flavins in blue light-sensing photoreceptors. Photochemistry and Photobiology 87 491-510 DOI:10.1111/j.1751-1097.2011.00913.x
- 3rh8 2011 Structure of a light-activated LOV protein dimer that regulates transcription. Science Signaling 4 ra50 DOI:10.1126/scisignal.2001945
- 2z6c 2008 Structural basis of the LOV1 dimerization of Arabidopsis phototropins 1 and 2. Journal of Molecular Biology 381 718-733 DOI:10.1016/j.jmb.2008.06.033
- 2pd7 2007 Conformational switching in the fungal light sensor Vivid. Science 316 1054-1057 DOI:10.1126/science.1137128
- 1jnu 2002 Photoexcited structure of a plant photoreceptor domain reveals a light-driven molecular switch. The Plant Cell 14 1067-1075 DOI:10.1105/tpc.010475
- 1g28 2001 Structure of a flavin-binding plant photoreceptor domain: insights into light-mediated signal transduction. Proceedings of the National Academy of Sciences USA 98 2995-3000 DOI:10.1073/pnas.051520298
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









