182: インスリン受容体(Insulin receptor)
身体を構成する各細胞は、血流によって運ばれてくるブドウ糖(glucose)を主なエネルギー源としている。血流中のブドウ糖は複雑な信号伝達システムによって制御されており、足りない時には血中にブドウ糖が放出され、余っている時は血液から取り込んで貯蔵されるようになっている。この信号伝達システムにおいて中心的な役割を果たしているのが、インスリン(insulin)とグルカゴン(glucagon)という2種類のホルモンである。血糖値が下がると、すい臓のα細胞はグルカゴンを分泌する。グルカゴンは肝臓細胞を刺激して血流にブドウ糖を放出させる。逆に血糖値が上がると、すい臓のβ細胞がインスリンを分泌する。インスリンはブドウ糖の取り込んで代謝や貯蔵へと回すのを促す。どちらのホルモンも小さなタンパク質分子で、細胞表面にある受容体によって認識される。
信号の伝達
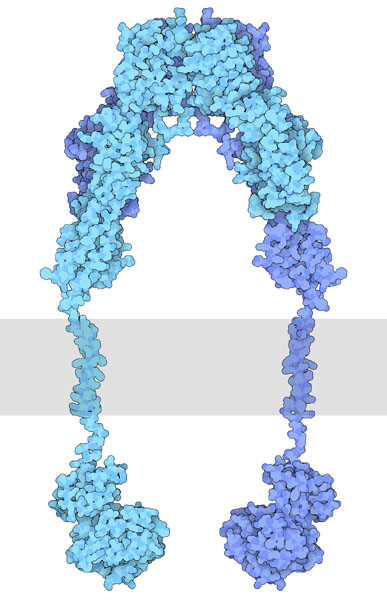
インスリン受容体(insulin receptor)は、インスリンに結合してその信号を細胞に伝える大きなタンパク質で、いくつかの機能部位から構成されている。2本のタンパク質鎖が細胞の外側に集まってインスリンに結合する受容体部位を形成する。この部分は膜を通して2つのチロシンキナーゼ(tyrosine kinases、チロシンリン酸化酵素、図の下部に示した部分)に結合している。インスリンがない時は締まった配置になっているが、インスリンが結合すると構造は緩む。そしてまず、2つの受容体部位が互いに相手をリン酸化し活性化し合う。次に細胞内の信号伝達ネットワーク内にある別のタンパク質をリン酸化する。受容体全体としては非常に柔軟なので、分子構造はいくつかの部位に分けて決定された。ここに図示するインスリン結合部位はPDBエントリー 3loh、膜貫通部位はPDBエントリー 2mfr、チロシンキナーゼ部位はPDBエントリー 1irkの構造である。
病気になってしまう時
インスリンの信号がうまく伝達できなくなると、血液中のブドウ糖濃度が適切に制御できなくなり、広まりをみせている糖尿病(diabetes mellitis)になってしまう。この病気に至る主な経路は、次の2つである。1型糖尿病はインスリンに問題があることで発生する。これには自己免疫によってインスリンを作るすい臓の細胞が破壊されて起こる場合もあれば、インスリンが突然変異を起こして不活性なものとなる場合もある。このタイプの糖尿病は幼少期に発症し、インスリンを補って正常なインスリンが欠けている状況を改善させる治療が必要となる。一方、2型糖尿病は多くの場合年をとってから発症する。こちらの場合、インスリンの作用に対して受容体が耐性を獲得してしまうことに起因する。発症に至る詳細な機構は複雑で、インスリンの信号伝達よる作用に変化を生じさせる、受容体とその基質のリン酸化が関係している。治療は食事、生活習慣、投薬についての慎重な配慮の下で行われる。
インスリンを作る
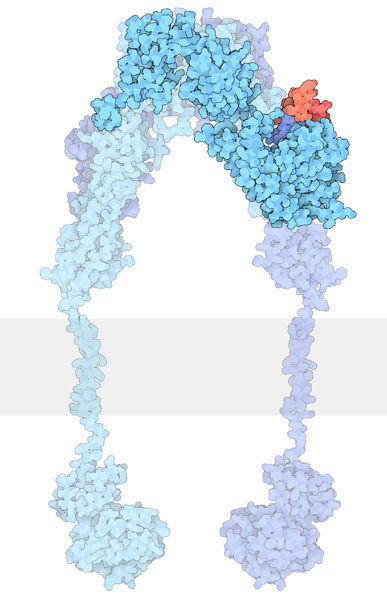
インスリンが受容体に結合すると、受容体の形状に変化が起きてそれが細胞内部分に伝わり、チロシンキナーゼを活性化すると考えられている。だが詳細はまだ謎につつまれており、懸命な研究が行われているところである。最近インスリンがインスリン受容体の一部に結合した構造が解かれた。上図はPDBエントリー 3w14の構造で、インスリンを赤で示している。この構造によりパズルのピースがまた一つ置かれたことになる。驚くべきことに、インスリンが結合するのは受容体の先の方ではなく少し細胞膜寄りの側面で、しかも通常は対称的な形をした受容体の片方にしか結合しない。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
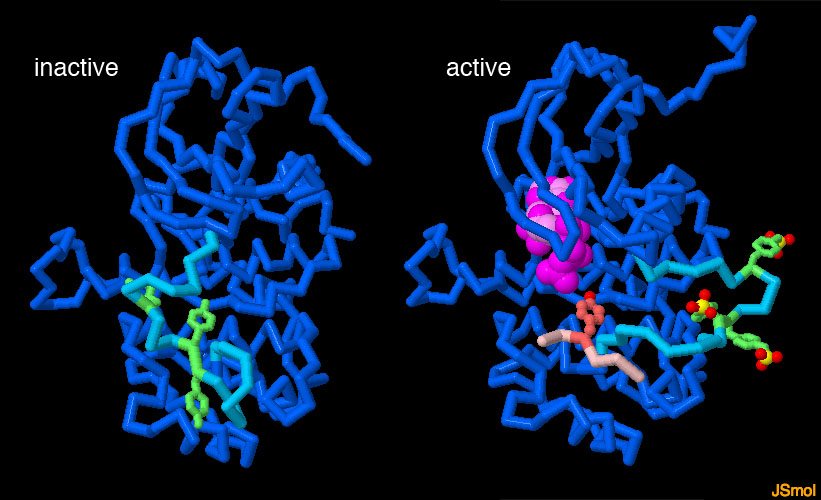
受容体のチロシンキナーゼ部分は、それ自体が多くの可動部分を持つ活動的なタンパク質になっている。活性部位にはATPが結合し、このATPが対象をリン酸化するのに用いられる。不活性状態(左、PDBエントリー 1irk)では、可動ループ(青緑)が活性部位に結合して活動を妨げている。受容体が活性化されると、ループ中にあるいくつかのチロシン(緑)がリン酸化され、それによってループは活性部位からはじき出される。その結果ATP(赤紫)が活性部位に入れるようになる(右、PDBエントリー 1ir3)。次に、他の信号伝達タンパク質(そのうちの一つに由来する短いペプチドをピンクで示す)が結合し、その中にあるチロシンアミノ酸がリン酸化される。上図の下のボタンをクリックして対話的操作のできる画像に切り替え、2つの構造をより詳しく見てみて欲しい。
理解を深めるためのトピックス
- RCSB PDBで提供されているProtein Feature Viewの「インスリン受容体」ページは、受容体のどの部分が各PDBエントリーに含まれているのかを知るのに役立つでしょう。
- PDBエントリー3lohなどのインスリン受容体のインスリン結合部分の構造は、抗体を付加した複合体を結晶化させて解かれています。構造を見るとき、抗体部分は無視するようにしてください。なぜなら抗体は生物学的に機能する状態では含まれていないからです。
- 糖尿病に関する様々な情報をインターネットで得ることができます。例えば、世界保健機関(World Health Organization)、Diapediaなどが役に立つかも知れません。
参考文献
- 2mfr 2014 Solution structure of the transmembrane domain of the insulin receptor in detergent micelles. Biochimica et Biophysica Acta 1838 1313-1321 DOI:10.1016/j.bbamem.2014.01.005
- 2013 The insulin receptor: both a prototypical and atypical receptor tyrosine kinase. Cold Spring Harbor Perspectives in Biology 5:a008946 1-12 DOI:10.1101/cshperspect.a008946
- 3w14 2013 How insulin engages its primary binding site on the insulin receptor. Nature 493 241-245 DOI:10.1038/nature11781
- 2013 The insulin receptor changes conformation in unforeseen ways on ligand binding: sharpening the picture of insulin receptor activation. Bioessays 35 945-954 DOI:10.1002/bies.201300065
- 2012 Regulation of insulin sensitivity by serine/threonine phosphorylation of insulin receptor substrate proteins IRS1 and IRS2. Diabetologia 55 2565-2582 DOI:10.1007/s00125-012-2644-8
- 2011 Landmarks in insulin research. Frontiers in Endocrinology 2:76 1-11 DOI:10.3389/fendo.2011.00076
- 3loh 2010 Structural resolution of a tandem hormone-binding element in the insulin receptor and its implications for the design of peptide agonists. Proceedings of the National Academy of Science USA 107 6771-6776 DOI:10.1073/pnas.1001813107
- 1ir3 1997 Crystal structure of the activated insulin receptor tyrosine kinase in complex with peptide substrate and ATP analog. EMBO Journal 16 5572-5581 DOI:10.1093/emboj/16.18.5572
- 1irk 1994 Crystal structure of the tyrosine kinase domain of the human insulin receptor. Nature 372 746-754 DOI:10.1038/372746a0
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









