179: メチル補酵素M還元酵素(Methyl-coenzyme M Reductase)
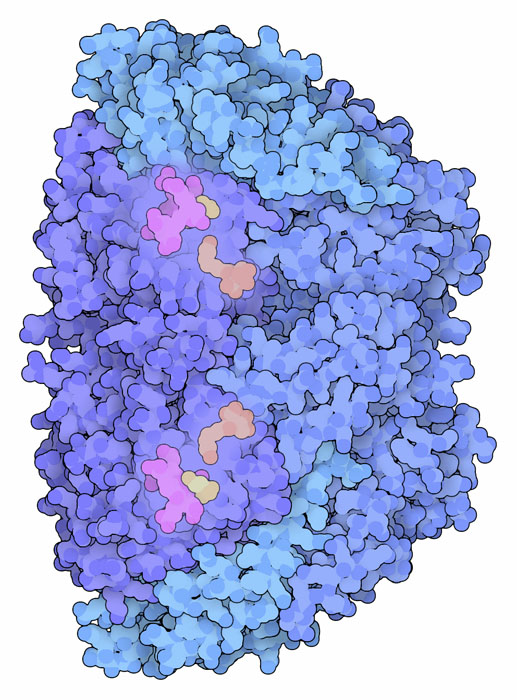
メタン生成古細菌は毎年何十億トンものメタン(methane)を作っている。メタン生成菌は細菌に似た小さな微生物で、湖底や沼底、ウシやヒトの臓器などの嫌気的環境に生息している。発酵細菌によって作られる二酸化炭素、メタノール、酢酸などの分子を摂取し、老廃物としてメタンを放出する。水の底から放出されたメタンは泡となって水面に上り沼気となる。私たちの体内に生息するメタン生成菌から出たものは、社会的に容認され難い「おなら」の成分となる(訳注:メタン自体は無臭)。
メタンを作る
大半のメタン生成菌は水素ガスと二酸化炭素をメタンと水に変換する。この巧妙な操作には、炭素から酸素原子を引き離して水素に付加する反応を段階的に行う一連の酵素を必要とする。ここに示すのはメチル補酵素M還元酵素(Methyl-coenzyme M Reductase、PDBエントリー 1mro)と呼ばれる酵素で、この反応の最終段階を行いメタンを放出する。6本の鎖で構成される大きな複合体で、3種類の鎖がそれぞれ2本ずつある。この酵素には、トンネルの奥深くに埋もれ周辺の水と反応しないよう保護されている活性部位が2つある。
メタン産生に関する賛否
最近、メタン生成菌はより注目されるようになってきた。それは、これまで捨てられていた汚水や肥料などの生物的廃棄物を、暖房や発電などに使える有用なバイオガスに変換する手段として使えるからである。メタン生成菌は、嫌気性消化槽の中で様々な他の嫌気性微生物と混ぜられ、一緒になってあらゆる種類の生物学的分子をより単純な化合物へと分解する。また地球温暖化に関することでも注目されている。天然に産出されたメタンの約3分の1は温室効果ガスとして大気中に漏れ出ているからである。
取引の道具 Tools of the Trade
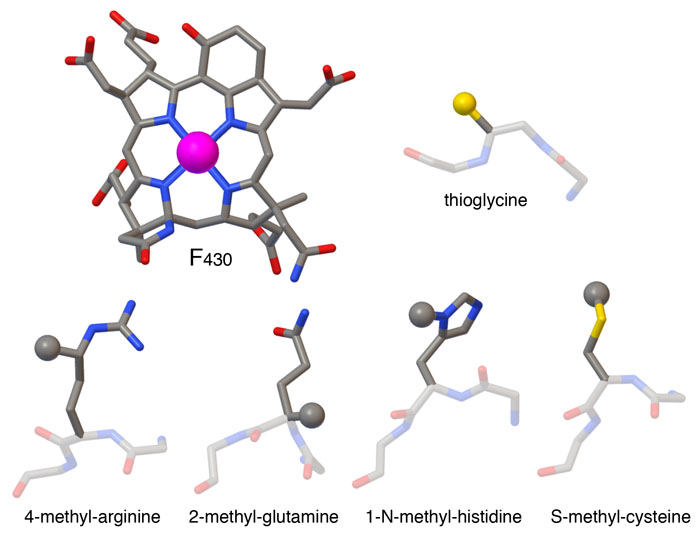
メチル補酵素M還元酵素によって行われる反応は容易ではなく、いくつかの独特な分子の助けを借りる必要がある。この酵素はF430と呼ばれる独特の補因子を含んでいる。この補因子は、ヘモグロビン(hemoglobin)で用いられるヘム(heme)に似ているが、いくつか追加の環構造があり、ヘムよりも二重結合が少ない。また含む原子は鉄ではなくニッケルである。F430の環はニッケル原子を高い活性化状態で安定化させるが、これは反応にとって重要なことである。なぜなら、基質となるメチル補因子Mはかなり不活性な分子だからである。反応は酵素の活性部位を取り囲む修飾アミノ酸によってさらに推進される。メチル基が4つの異なるアミノ酸に付加され、ある特定のグリシン中にある酸素原子が硫黄原子に置換される。
構造をみる
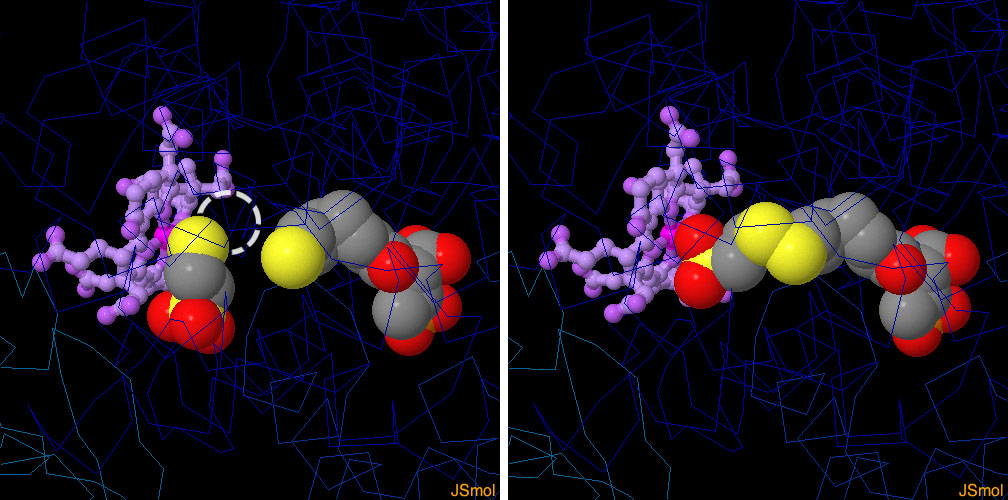
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
この2つの構造から、酵素の反応前と反応後の様子を垣間見ることができる。反応前は、補因子Mと補因子Bが酵素に結合している。この2分子のうち、メチル基を運ぶのは補因子Mの方である。酵素はメタンの形でメチル基を放出し、2つの補因子をジスルフィド結合でつなげる。このジスルフィド結合でつながった珍しい分子は、細胞によってエネルギー産生に用いられる。PDBエントリー 1mro(左)の構造は、反応前の2つの補因子を示している(この構造にメチル基は含まれていないが、通常は小さい方の補因子に付加されている。その位置を点線の円で示している)。PDBエントリー 1hbm(右)の構造は、反応後のつながった補因子を示している。図の下のボタンをクリックして対話的操作のできる画像に切り替え、より詳しく見てみて欲しい。
理解を深めるためのトピックス
- RCSB PDBのリガンドエクスプローラ(Ligand Explorer、個別PDBエントリーのSummaryページ右の画像をAsymmetric Unixに切り替えるとその下にリンクがあります)を使うと、F430を固定しているアミノ酸、2つの基質の場所などを見ることができます。
- ニッケルが酵素で用いられることはあまりありませんが、ニッケル-鉄ヒドロゲナーゼ(nickel-iron hydrogenase)のように小さな気体分子に関係する反応で時々用いられます。多くの細菌は周辺環境からニッケルを集めるためのタンパク質系を持っています。「ニッケル 輸送」(nickel transport)で検索し、そのようなタンパク質をいくつか探してみてください。
参考文献
- 2005 On the mechanism of methyl-coenzyme M reductase. Dalton Transactions 2005 3451-3458 10.1039/B506697B
- 1hbm 2001 On the mechanism of biological methane formation: structural evidence for conformational changes in methyl-coenzyme M reductase upon substrate binding. Journal of Molecular Biology 309 315-330 10.1006/jmbi.2001.4647
- 1mro 1997 Crystal structure of methyl-coenzyme M reductase: the key enzyme of biological methane production. Science 278 1457-1462 10.1126/science.278.5342.1457
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









