122: エンハンセオソーム(Enhanceosome)
あなた自身の身体についてしばらく考えてみて欲しい。顔の形、目の色、指の長さ、骨と筋肉がぴったり合わさった関節、髪が巻き癖があるのかまっすぐなのか...。では次に想像の旅を内部へと進め、さまざまな細胞が持つ複雑な形と機能、そしてそれぞれの中に広がるあふれんばかりの分子世界について考えてみよう。意外にもこの驚くべき構造、形、機能は、たった20,000から25,000種のタンパク質をコードする遺伝子のゲノム情報によって決められている。そして大いなる難問の一つであるこれら遺伝子の仕組みや、発現を制御し生命のあらゆる場面でそれぞれの特徴を方向付ける手法について今解明されつつある。
組み合わせによる制御
ある条件下でどの遺伝子が発現するのかを特定するため、細胞は様々なDNA結合タンパク質を使ってDNAの読み取りを制御している。驚くべきことに、このようなタンパク質は比較的少なく、ある見積もりによると、ヒトのゲノム中にコードされているそのようなタンパク質は約2,600種である。しかし、この限られた一群のタンパク質が持つ遺伝子活性化能力は、組み合わさることや2つ以上のタンパク質が同時に結合することによって飛躍的に向上する。こうして各タンパク質はさまざまな方法で使われ、反応の範囲ははるかに多様なものとなるのである。
転写の促進
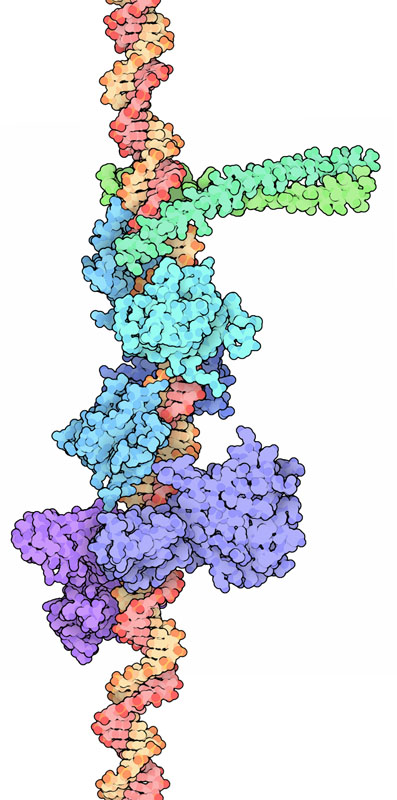
右図に示したDNAとタンパク質の複合体は、転写エンハンセオソーム(transcriptional enhanceosome、転写因子複合体、PDBエントリー 1t2k、2pi0、2o6g、2o61)で、ウイルス感染と闘うのに重要なタンパク質「インターフェロン-β」(interferon-beta)の発現を制御している。細胞はウイルスに感染すると、「ATF-2/c-Jun」(上部にある緑の分子)、「インターフェロン反応因子」(interferon response factor、IRF、中央にある青緑の分子)、「核因子kB」(nuclear factor kB、NF-kB、下部にある青と赤紫の分子)を含む何種類かのDNA結合タンパク質を作り出す。それぞれのタンパク質は、単独では遺伝子を活性化する能力が十分ではない一方で、別の遺伝子の活性化においても役割も果たしている。例えば、Nf-kBは免疫応答(immune response)、炎症(inflammation)、能動的な細胞死(アポトーシス apoptosis)などさまざまな過程においても重要である。ところがこれらタンパク質が全てが結合して一緒になると、遺伝子が活性化されインターフェロンが作り出される。
信号の統合
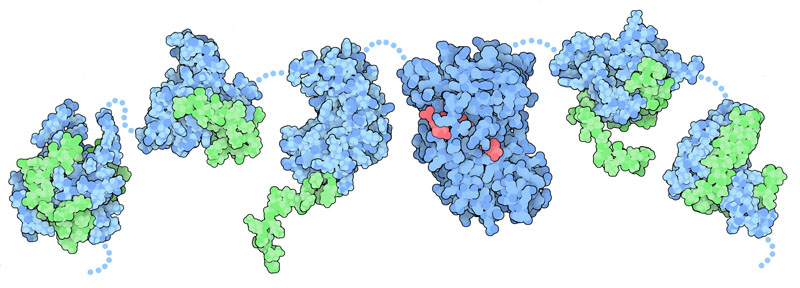
一旦転写因子(transcription factor)が遺伝子本体の配列とは別領域にあるエンハンサーDNA配列(enhancer DNA sequenece、転写促進DNA配列)に結合すると、次は転写を活性化する指令が何らかの方法で検知され、遺伝子の転写が活性化されなければならない。多くの場合、これはCREB結合タンパク質(Cyclic AMP Response Element Binding (CREB) binding protein、環状AMP応答配列結合タンパク質結合タンパク質)またはそれに似たタンパク質であるp300を使って行われる。このタンパク質(PDBエントリー 1l8c、1kdx、1jsp、3biy、2ka6、1kbh)は多くのドメインがつながって構成されており、各ドメインはそれぞれ別々の集合エンハンセオソーム構成タンパク質に結合する。その時、中心にある大きなドメインはヒストンアセチル基転移酵素(histone acetyltransferase)として働き、ヌクレオソーム(nucleosome)にあるヒストンに修飾を加えてヌクレオソームを解体し、遺伝子を露出させる。インターフェロン-β 遺伝子は通常、ヌクレオソームが転写開始部位を覆っていて、転写が妨げられている。集合したエンハンセオソームはこのヌクレオソーム除去を誘導し、遺伝子が発現できるようにしている。
構造をみる
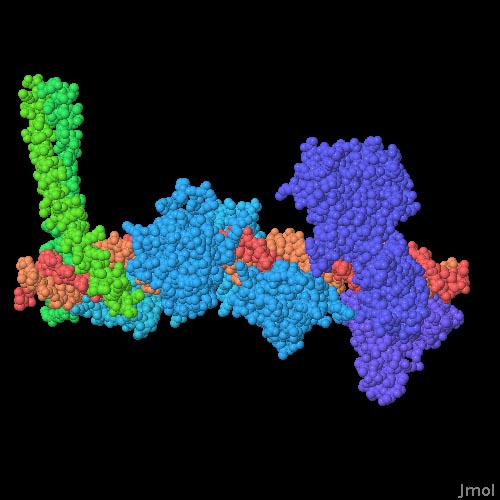
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
ここに示す完全なインターフェロン-βエンハンサーのモデルは、いくつかの結晶解析によって解かれた構造(PDBエントリー 1t2k、1pi0、2o6g、2o61)に基づきダニエル・パンネ(Daniel Panne)氏が作成したものである。これによりエンハンセオソームの集合に関して驚くべき事実が明らかになった。まず、DNAがほとんどまっすぐであったことである。これについて、ある研究者はDNAがかなり曲げられていると予想していた。次に、タンパク質間の相互作用は極めて限られていたことである。タンパク質の結合には協力が必要で、1つのタンパク質が結合すると、残りのタンパク質結合も促進されることが知られていただけのこの結果は意外であった。ただこれは、いくつかの事柄により生じた結果かもしれない。数個のタンパク質がDNAの同じ部位の両側に結合し、その結果タンパク質はDNAを少しだけ曲げてより適した構造に変化させて結合を促進しているのかもしれない。またATF-2/c-JunとIRFタンパク質の結晶構造は、タンパク質のDNA結合部分だけを使って解かれた。そのためタンパク質の欠けている部分は、隣接するタンパク質と協力的に相互作用しているかもしれない。最後に、細胞内でCREB結合タンパク質またはp300(前項で示した分子)は異なるタンパク質への結合を通して強い協調効果を生んでいるのかもしれない。図の下のボタンをクリックして、対話的操作のできる画面へと切り替えてみて欲しい。
理解を深めるためのトピックス
- これらタンパク質の一部はPDBに追加で構造が登録されている。そのような追加構造はエンハンセオソーム複合体内にあるタンパク質と構造の上で似ているでしょうか?
- DNAの認識には様々な種類のタンパク質折りたたみモチーフ(protein folding motif、特有の折りたたみのパターン)が用いられています。DNA認識に用いられる他のモチーフをPDBで見つけることができますか?
参考文献
- 2007 An atomic model of the interferon-b enhanceosome. Cell 129 1111-1123
- 2008 The enhanceosome. Current Opinion in Structural Biology 18 236-242
- 2008 Structure and chemistry of the p300/CBP and Rtt109 histone acetyltransferases: implications for histone acetyltransferase evolution and function. Current Opinion in Structural Biology 18 741-747
ヒトゲノムの遺伝子数
- 2004 Finishing the euchromatic sequence of the human genome. Nature 431 931-945
ヒトゲノムの転写因子数
- 2004 Structure and evolution of transcriptional regulatory networks. Current Opinion in Structural Biology 14 283-291
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









