117: キサンチン酸化還元酵素(Xanthine Oxidoreductase)
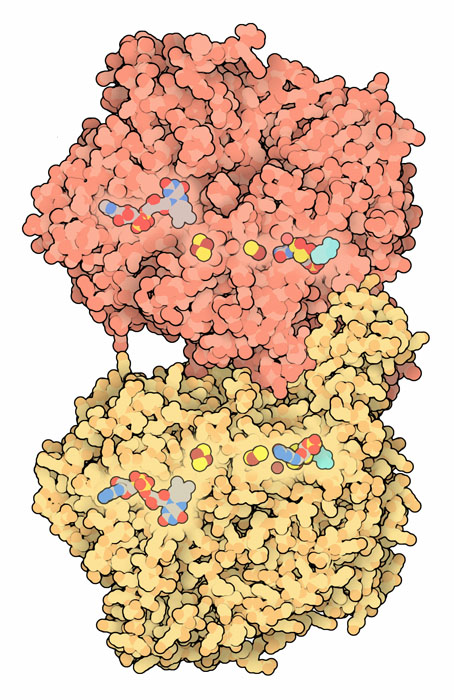
私たちの食事には広範囲にわたる様々な分子を含んでいる。その多くは完全に分解され、細胞に動力を与える代謝エネルギーを作り出すのに使われる。他のものはバラバラに分解され、私たち自身のタンパク質や核酸を作るのに再利用される。そして残りは分解されて排出される。ここに示すキサンチン酸化還元酵素(xanthine oxidoreductase、PDBエントリー 1fo4)は、細胞内にある余分なプリンヌクレオチド(purine nucleotide、ATP と GTP)が最後にとどまるところである。プリンは数段階を経て分解され、最終的には尿酸(uric acid)となって身体から排出される。
電子の取り出し
キサンチン酸化還元酵素は周囲にある電子を動かすので、電子を操作するための特別な分子道具を持っている。この酵素の一端には、基質のプリンに結合してヒドロキシル基を付加する活性部位がある。この巧妙な反応は、モリブデン原子(molybdenum atom)を含む補因子(cofactor)によって行われる。電子はこの過程で取り出され、その電子を一連の鉄硫黄クラスター(iron-sulfur cluster)がプリン活性部位から酵素の反対側へと通す。そして最終的に電子はNADまたは酸素へと渡される。
役割の支え
キサンチン酸化還元酵素は細胞内で見られ、プリンの分解における役割を果たしている。だがこの酵素は牛乳にも豊富に含まれており、極めて簡単に単離し精製することができるため、研究対象としてもよく知られている。牛乳ではいくつかの役割を果たしていると考えられている。酸素を伴う反応では、過酸化水素(hydrogen peroxide)を放出する。過酸化水素は大変反応性に富む物質である。この反応の助けによって牛乳は抗細菌性を持っているのかもしれない。また牛乳が作られる際、脂質粒子を分泌する時にも中心的な役割を果たしている。驚くべきことにこの役割は、乳腺(mammary gland)細胞の細胞膜におけるキサンチン酸化還元酵素と他のタンパク質との相互作用に依存していて、この酵素の触媒活性には依存していないようである。
痛みを伴うプリン
キサンチン酸化還元酵素の阻害剤(inhibitor)は痛風(gout)の治療に役立つ。痛風は、関節(特に足の親指(big toe))に尿酸の結晶が集まって痛みを伴う炎症を引き起こす疾患である。痛風を招く条件はまだよく分かっていない点があるが、血液中の尿酸濃度が高いことと関係しているようである。これはプリンが豊富な食事によって引き起こされうる。プリンはカタクチイワシ(anchovy)、イワシ(sardine)、レバー(liver)、アスパラガス(asparagus)、マッシュルーム(mushroom)などに豊富に含まれている。キサンチン酸化還元酵素の働きを阻害するアロプリノール(allopurinol、商品名アロリン Allorin、ザイロリック Zyloric)などの薬は尿酸の産生を抑え、血液中の尿酸濃度を下げる。
完全な分解
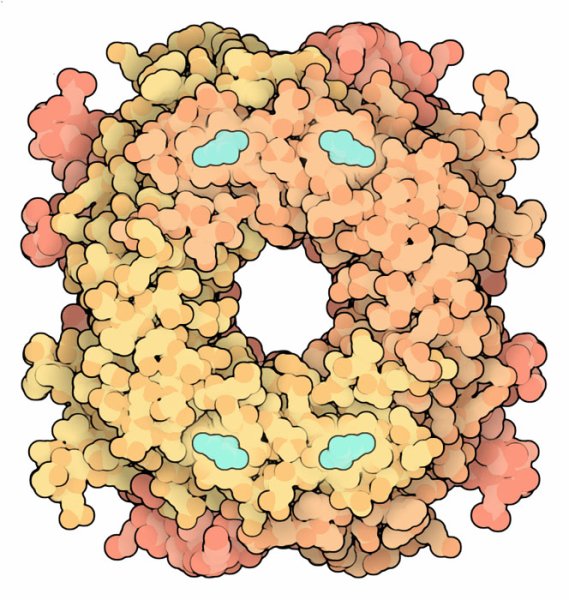
ほとんどの生物は更にプリンを分解するための追加酵素を持っている。尿酸酸化酵素(urate oxidase、PDBエントリー 1r4u)および他数種類の酵素がそれで、最終的には尿酸よりも水に溶けやすく排出しやすいアラントイン(allantoin)を作り出す。また中には更に分解を進め、アンモニア(ammonia)と二酸化炭素(carbon dioxide)にまで分解する生物もいる。だが不思議なことに私たちの持つ尿酸酸化酵素の遺伝子は変異していて不活性である。科学者はヒトが進化する間にこの遺伝子が変異し、老化に関するある利点を与えてくれたのではないかと仮定している。尿酸は強力な抗酸化物質(antioxidant)であり、進化の過程で尿酸酸化酵素が失われたことによって血液中の尿酸濃度が上がったことで、長い障害に渡って酸素の障害から私たちを守る助けをしてくれているのかもしれない。
構造をみる
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
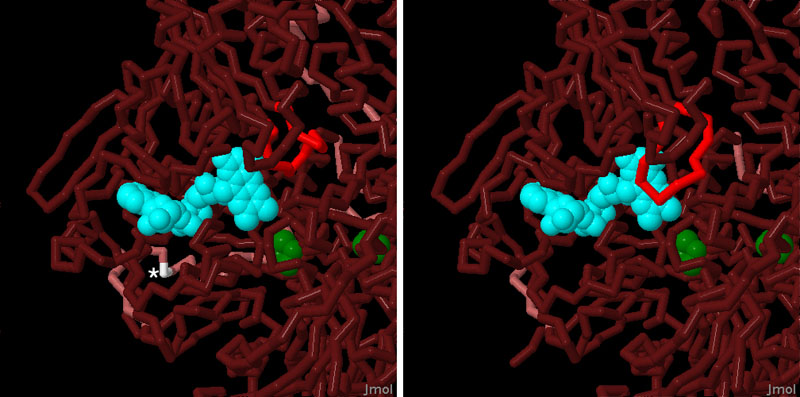
実は、キサンチン酸化還元酵素1つの中に2つの酵素がある。この酵素に関する初期の研究で、研究者たちはNADを用いる型と、それとは別の酸素を用いる型とを精製した。最初はそれぞれ別々の酵素であると考えられ、キサンチン脱水素酵素(xanthine dehydrogenase)とキサンチン酸化酵素(xanthine oxidase)という2つの名前が付けられた。ところが、最終的にアミノ酸配列を見て、両者は同じであることが分かった。これら2つの型の違いは、2つの方法によって作り出される。1つは、酵素内のジスルフィド架橋(disulfide bridge)によるものである。もし架橋が形成されれば酵素は酸化酵素として働き、架橋が切断されれば脱水素酵素として働く。もう1つは、タンパク質分解酵素(protease)による酵素の切断によるものである。酵素が切断されると、常時酸化酵素として働く型となる。ここでは2つの例を示した。左に示したのが脱水素酵素型(PDBエントリー 1fo4)、右に示したのがタンパク質分解酵素によって切断された酸化酵素型(PDBエントリー 1fiq)である。切断部位の1つを、星印を付した白い線で示す。電子伝達系の最終段階は、青緑色で示したFADグループである。脱水素酵素型では電子をNADに渡すが、酸化酵素型ではFADを覆うタンパク質の環(鮮やかな赤で示した部分)に渡す。この環はNADを締め出すが、FADからの電子を受け取る小さな酸素分子は入れるようにしている。
他にもキサンチン酸化還元酵素のリガンド結合部位の詳細を示している構造がいくつかPDBに登録されている。例えば、PDBエントリー 1jrp は、プリンに似た阻害剤が結合したモリブデン補因子を伴う酵素を示している。その相互作用の様子を "Ligand Explorer" を使って見ることができる。次項を参照して欲しい。
文中に登場するPDB IDをクリックして表示されるPDBj検索結果の「Sequence Neighbor」ページで、キサンチン酸化還元酵素と似た配列を持つエントリーの最新リストを見ることができる。
Ligand Explorerで活性部位を見る
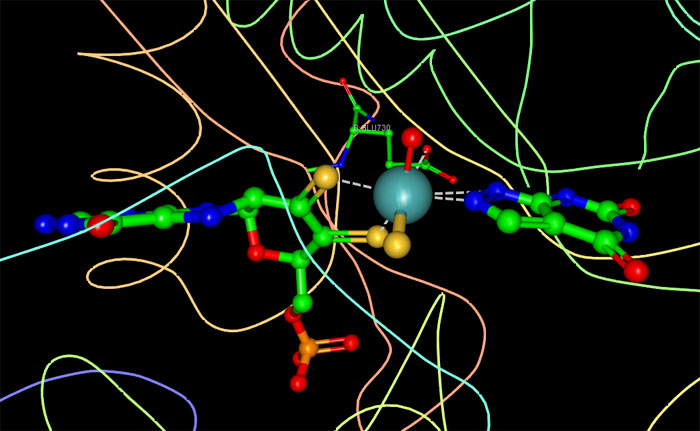
右図はキサンチン酸化還元酵素(PDBエントリー 1jrp)の活性部位を示したもので、Ligand Explorerを使いリガンドと補因子を見ている。中心にあるのはモリブデン原子で、右にあるのは阻害剤、左でモリブデンをつかんでいるのが補因子である。モリブデンには、補因子および阻害剤との相互作用と同様に、酸素と硫黄が配位していることに注目して欲しい。画像をクリックすると、Ligand Explorerを使った対話的操作のできる画面を表示できる。その画面では任意のリガンドや補因子を選らんで見る事ができる。右図はモリブデンを中心にして描いたものである。モリブデンはPDBファイルでは"MOS"という名前が付けられている。
理解を深めるためのトピックス
- モリブデンは珍しい元素で、数種の酵素でのみ用いられています。他のモリブデンを使った酵素の例をPDBで見つけることができますか? 他の事例でもモリブデンイオンをつかみ活性化するのに同じような補因子を使っているでしょうか?
- PDBエントリー 3eub のキサンチン酸化還元酵素の活性部位には、基質のキサンチンが結合しています。研究者はどのようにして化学変化を起こすことなく酵素の構造を得たのでしょうか?
参考文献
文中に登場する構造について記した文献の概要を読むには、各PDB IDをクリックし、「Primary Citation」にあるPubMedまたはDOIのリンク先に進めばよい。以下に一般的な文献の情報を示す。
- 2004 Physiological roles of xanthine oxidoreductase. Drug Metabolism Reviews 36 363-375
- 2005 Molecular physiology of urate transport. Physiology 20 125-133
- 2005 Molybdenum-containing hydroxylases. Archives of Biochemistry and Biophysics 433 107-116
- 2008 Mammalian xanthing oxidoreductase-mechanism of transition from xanthing dehydrogenase to xanthine oxidase. FEBS Journal 275 3278-3289
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト