026: ニトロゲナーゼ(Nitrogenase)
窒素(nitrogen)はタンパク質や核酸を作るため全ての生命において必要とされる元素である。窒素ガスは地球上でごく一般的にみられ、空気中分子の75%以上を占めている。ところが窒素ガスは非常に安定であり、個々の窒素原子へと分解するのは難しい。利用可能なアンモニア(ammonia)または硝酸塩(nitrate salt)の形になっている窒素は多くはない。植物の生長が土壌中の利用可能な窒素量によって制約を受けることはよくある。少量の利用可能な形の窒素が日光からの可視光線や紫外線によって作られるが、植物に供給される窒素うちかなりの量は工業的に作られた肥料によってまかなわれている。しかし、利用可能な窒素の供給源として最も多くの割合を占めるのは、細菌が()を使って作り出す分である。
窒素固定
窒素固定細菌(Nitrogen-fixing bacteria)は窒素ガスをアンモニアに変換する能力を持っている。アンモニアであれば容易に他の原材料とつなげてタンパク質や核酸の構成単位を作ることができる。ただ窒素ガスは非常に安定なガスであるため、変換を行うには強行な手段が必要である。アンモニアを工業的に生産するには、高温と300気圧に加え触媒が必要である。一方窒素固定細菌では、酵素の()が大量のATPを使って反応を進める。この酵素は珍しいモリブデン(molybdenum、Mo)イオンを含む金属イオン群を使って反応を行っている。
高くつく反応
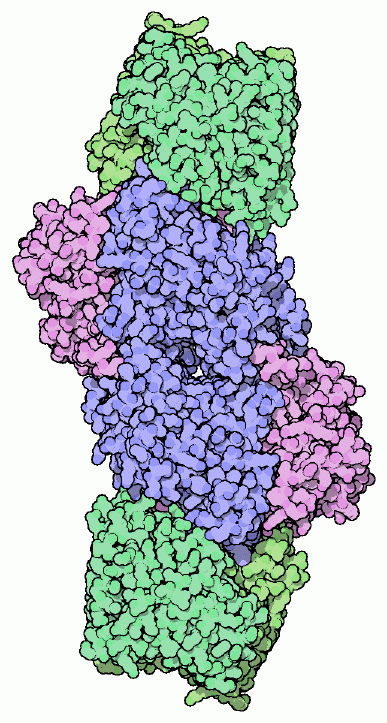
ここに示す(PDBエントリー 1n2c)は2つの部分で構成されている。青と赤紫で示す「モリブデン鉄タンパク質」(MoFe protein)には反応を行う機構全てが含まれているが、安定した電子供給源が別途必要である。窒素を分断してアンモニアに変換する反応において、窒素1分子当たり6個の電子を付加する必要があるが、これに必要な電子は緑で示した「鉄タンパク質」(Fe protein)がATPの切断で得られるエネルギーを使って供給している。標準的な反応では、1個の電子を供給するのに2分子のATPが消費される。は反応の際、同時に水素イオン(hydrogen ion)を水素ガスに変換する反応も行う。これは窒素を分断する反応にとって必要不可欠な部分なのかもしれないし、単なる副反応なのかもしれないが、とにかくこの反応が合わせて起こることでより多くのATPが消費されてしまう。
この反応には大きなエネルギーが投入されるが、窒素が使えない環境では十分見合うだけの価値がある。幸いにして、窒素固定細菌は世界中でみられ、しばしば植物と共生している。例えば、マメ類は特有の根粒(nodule)を根に作って、細菌にとっての最適な住み処を提供している。植物は避難場所だけでなく幾分の不可欠な栄養素さえも細菌に提供し、来るものを用心深く監視している。一方細菌は安定して窒素源を植物に供給している。
窒素を分断する金床
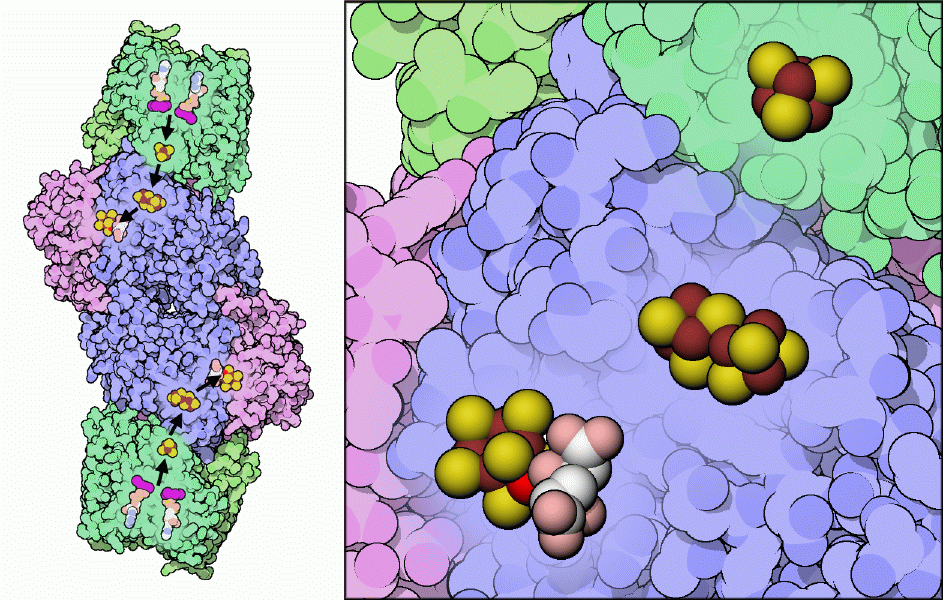
の要は、鉄、硫黄、モリブデンイオンによる珍しい複合体で、これを使って窒素固定反応が行われると考えられている。一連の補因子がこのモリブデン鉄クラスター(MoFe-cluster)に電子を供給する。上図左に示すように、電子は1組のATP分子(2量体となった複合体の両端にそれぞれ位置している)から供給され、鉄硫黄クラスター(iron-sulfur cluster)、Pクラスターへと流れ込み、最終的にモリブデン鉄クラスターに到達する。3つの金属クラスター部分を拡大して上図右に示す。下方にはモリブデン鉄クラスターがあり、モリブデン原子は鮮やかな赤で示している。炭素原子を白で、酸素原子をピンクで示したホモクエン酸(homocitrate)分子は、この珍しい金属イオンの安定化を助けている。また中央にはPクラスターが、上方には鉄タンパク質中にある鉄硫黄クラスターが示されている。の見事な構造(ここに示すのはPDBエントリー 1n2c)によって詳細な知見が得られているにも関わらず、窒素ガスの結合部位が実際どこであるのかについては未だ議論の中心となっており、精力的に研究が進められている。
構造をみる
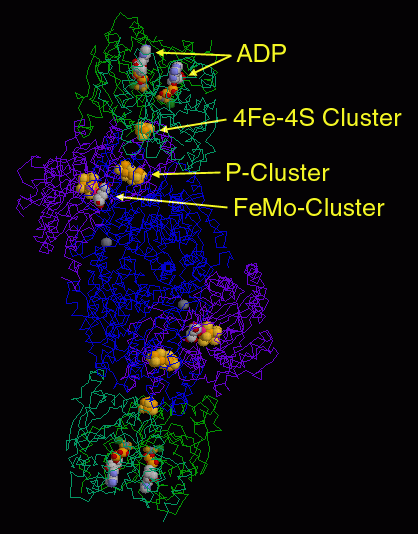
金属クラスターはの最も重要な部分であり、いろんな構造をみて回る上での大きな魅力となっている。PDBエントリー 1n2c はまず最初に見る構造としていい。このエントリーの構造には、「モリブデン鉄タンパク質」(中央にある青と赤紫で示した分子)と「鉄タンパク質」(両端にそれぞれ結合した緑の分子、それぞれ2量体になっている)の両方が含まれているのだから。金属イオンの各原子を球で表現すれば簡単に表示することができ、鉄硫黄クラスター、Pクラスター、モリブデン鉄クラスターが一列に並んでいることが分かる。ATP結合部位は独特のATP類似物質を使ったこの構造によって明らかになった。ここで使われたのは、ADP分子にフッ化アルミニウム(aluminum fluoride、AlF3)イオンが結合したものである。鉄タンパク質の両端に2個ずつこのATP類似物質が結合し、安定だが活性を持たない複合体を形成している。これにより本質的に鉄タンパク質をモリブデン鉄タンパク質にくっつけて構造が解けるようにしている。
"" のキーワードでPDBエントリーを検索した結果はこちらで参照できます。
更に知りたい方へ
以下の参考文献もご参照ください。
- 2000 Nitrogenase: Standing at the Crossroads. Current Opinion in Chemical Biology 4 559-566
- 1994 Nitrogenase and Biological Nitrogen Fixation Biochemistry 33 389-397
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









