25: トロンビン(Thrombin)
酸素と栄養分は血液による水っぽい輸送機構を通して体全体に運ばれている。ところがこの液体による輸送法を使うと2つの問題に直面する。1つは、身体全体を感染に対して無防備な状態にしてしまうことである。なぜなら細菌やウイルスは血液が行く場所ならどこでも素早く広まるからである。抗体(antibody)を最初の防衛戦とする免疫機構(immune system)がこの危険と戦う。もう1つの問題は、血液循環機構を損傷する危険が常にあるということである。血液は身体全体に圧力をかけて押し出されており、どんな小さな漏れでも機構全体を急速に空っぽにしてしまう可能性がある。幸いにして血液は緊急修復機構である血液凝固機構を持っている。切れたり、傷を負ったりした時、私たちの血液は傷を遮断する一時的なダムを作り、傷の周囲にある組織がより恒久的な修復を行うまでの時間を稼いでくれる。
分子のねずみ講
トロンビン(thrombin)は血液凝固過程の中心である。血液凝固は異常を検知する分子から始める。例えば、組織因子(tissue factor)タンパク質は細胞表面に見られ、通常血液と接触することはない。ところがもし組織が切れると、血液は血管から流れ出して組織因子と出会うことになる。そこで一連の信号が開始される。数個の組織因子分子で始まった信号が、ねずみ講のように増幅されて、問題部分全体を修復するのに十分大きな反応となる。組織因子は数個の第VII因子(factor VII)分子を活性化する。これが次に大量の第X因子(factor X)を活性化する。そして最後に更に多くのトロンビンが活性化される。トロンビンが活性化されると、この信号が実行に移される。トロンビンは大きなタンパク質のフィブリノーゲン(fibrinogen)から小片を切り取り、大きな繊維質網状構造への凝集を引き起こす。この網状構造が血液細胞をとらえ、傷を遮断する暗赤色のかさぶたを作る。
選択的消化
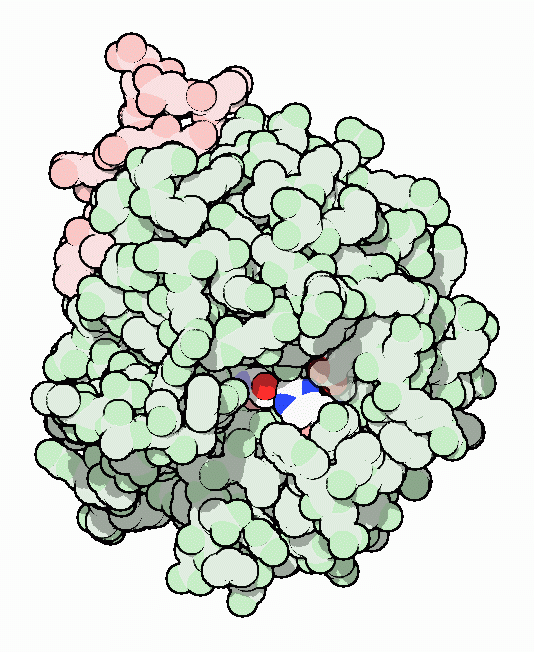
トロンビンはセリンプロテアーゼ(serine protease)の1つである。これはタンパク質を切断する酵素で、切断を行う際セリンアミノ酸を用いる。セリンプロテアーゼの他の例として、トリプシン(trypsin)やキモトリプシン(chymotrypsin)が挙げられる。これらは消化に関わる酵素である。ところがトロンビンはこれらの胃腸における切断機械よりもさらに特異性が強い。トロンビンはフィブリノーゲンを活性化するのに必要な特異的切断を行うよう設計されていて、血液中にある他の重要なタンパク質はどれも消化しない。示した構造はPDBエントリー 1ppbの活性化されたトロンビンのもので、深い溝の奥に活性部位を見ることができる。重要なセリンアミノ酸の酸素原子を明るい赤で、このセリンを活性化するヒスチジンの中にある2個の窒素原子を明るい青で示している。ヒスチジンの左に見えるアスパラギン酸と、もう一つ隠れて見えないアミノ酸も活性化を助けている。
正しい場所に、正しい時に
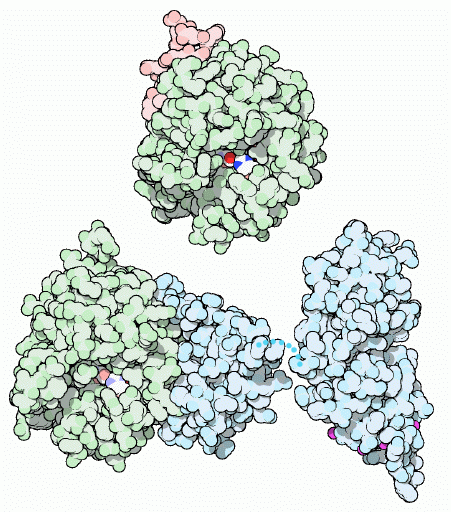
もちろん、血液凝固は注意深く制御されなければならない、さもないと血液は凝固する必要のない場所全てで凝固してしまうことになる。間違った血液の凝固が起これば破滅的な影響を与える。心臓における不適切な血液凝固は心臓発作(heart attack)を引き起こし、脳に誤ってできた血液凝固は脳卒中(stroke)を引き起こす。このようなことがないよう、トロンビンは2つの方法で血液凝固を制御している。まずトロンビンを作る際、最初は左図下に示した不活性型前駆体(左はPDBエントリー 1a0h、右は 2pf2の構造で、小さな点線部分は構造情報がない部分を示す)をとして作る。この不活性型にはいくつかの余分なドメイン(淡い青)があり、タンパク質が活性化される際に取り除かれる。左下の分子中にある青紫色の原子はカルシウムイオンで、特別な修飾を受けたグルタミン酸アミノ酸に結合している。これらの強く正に帯電したイオンはトロンビンを血管の表面につなぎとめる。そのためトロンビンは自由に広がることはなく、血液凝固が始まってもそれがあらゆる場所へと広がることはないのである。そして損傷を受けた部分に隣接したトロンビンだけが活性化される。トロンビン(左図上、PDBエントリー 1ppb)が活性化されるのはたった数秒間で、それによって凝固する部分を損傷部分だけに限定しているのである。
抗凝血剤
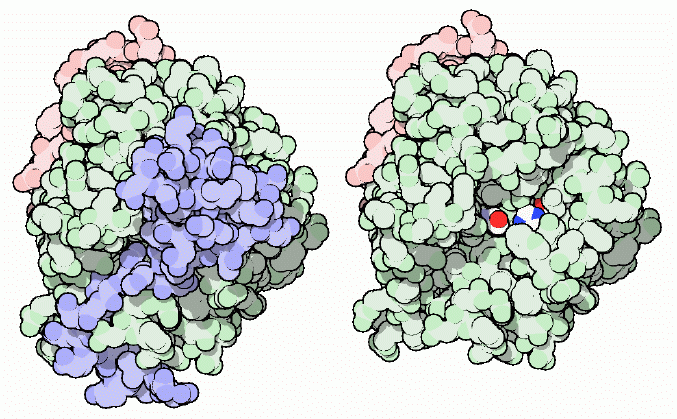
血液凝固はいつも必要な訳ではない。例えば、医師の指示の下少量のアスピリン(aspirin)を服用する人は多いが、これによって心臓発作を引き起こす血液凝固の機会は減少する。アスピリンはタンパク質シクロオキシゲナーゼ(cyclooxygenase)として働く。このタンパク質は血小板(platelet)と呼ばれる小さな細胞断片を使った血液凝固形成において別の視点から見ると重要な酵素である。今日あまり使われなくなった殺鼠剤のワルファリン(warfarin)は、カルシウムイオンをとらえる修飾されたグルタミン酸アミノ酸の形成を阻害する(次節参照)。不幸にしてこれを食べたねずみは出血が止められなくなり死んでしまう。またご推察のようにヒル(leech)も血液凝固を嫌うが、それは凝固が食事の終了を意味するからである。ヒルはトロンビンやその他の酵素を阻害する特別なタンパク質を作り、血液凝固形成を止める。その一例が、ヒルジン(hirudin、PDBエントリー 2hgt、上図左)と呼ばれるタンパク質である。ヒルのタンパク質は青で示している。どのようにしてトロンビン(淡緑、ピンク)の活性部位を完全に阻害しているのかに注意して欲しい。なお、上図右は比較のために示したトロンビン単体の構造である。
構造をみる
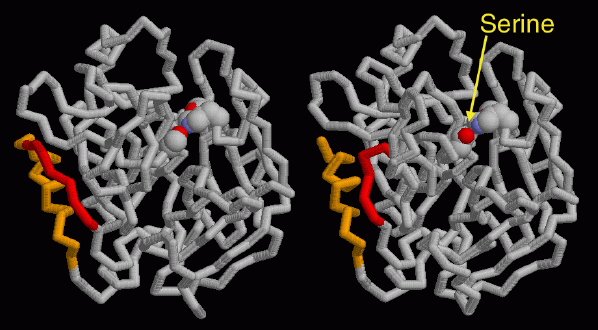
PDBエントリー 1mkxはトロンビンを見るための完全な構造である。この構造には不活性型(K鎖)と活性型(H鎖とL鎖)両方のタンパク質が含まれている。不活性型は左に示されている。タンパク質を活性化するためには、左側の分子の黄色の断片と赤の断片との間で切断しなければならない。切断されると、新たに生じた2つの末端は別れ、タンパク質全体がゆるんで右に示した活性型へと変化する。この際どのようにして、活性型の重要な触媒的セリンアミノ酸(その中の酸素原子を赤で示した)の位置が変化して活性部位の方を向き、切断を行う準備をしているかに注目して欲しい。
"トロンビン" のキーワードでPDBエントリーを検索した結果はこちらで参照できます。
トロンビンについてさらに知りたい方へ
以下の参考文献もご参照ください。
- 1993 A player of many parts: the spotlight falls on thrombin's structure. Thrombosis Research 69 1-58, PubMed ID:8465268.
- 1991 The coagulation cascade: initiation, maintenance and regulation. Biochemistry 30 10363-10370
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









