234: MDM2とがん(MDM2 and Cancer)
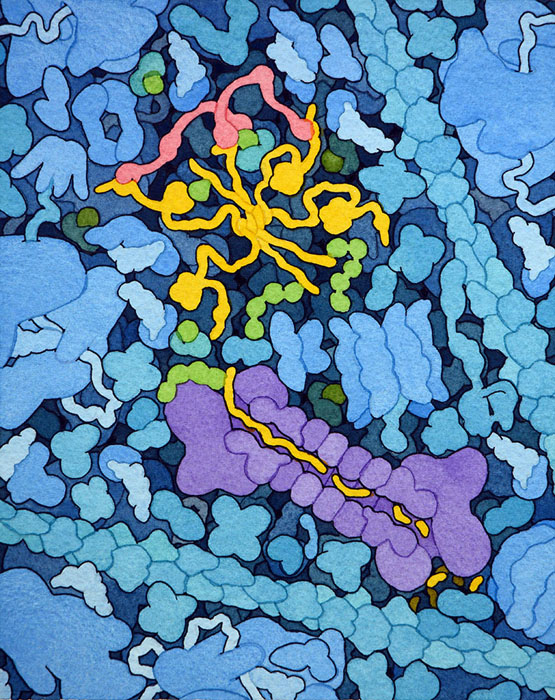
p53腫瘍抑制因子(p53 tumor suppressor)は私たちの細胞における番人である。損傷、感染、がん化が起きていないかを監視し、そのような事態を見つけると細胞の成長を停止させたり細胞の自己破壊を誘発させたりする。このp53腫瘍抑制因子はしっかりと制御しておかねばならないが、その仕事を行うのがMDM2(ヒトの細胞ではHDM2という名でも知られる)とその相手となるMDMXである。これらはp53を監視し、この究極的な結末が導かれるのは本当に必要な時にだけとなるようにしている。
番人を監視する
MDM2はほとんどの時間、p53と結合している。これには複数の効果がある。まず、MDM2が持つドメインの一つがp53のトランス活性化ドメインと結合し、その信号伝達作用を妨げる。MDM2の別の部分が核からの搬出指示信号をとらえる。この信号は p53を核から細胞質へと引きずり出し、遺伝子から引き離すことで遺伝子を活性化する。そして細胞質では、MDM2とMDMXが持つ別のドメインがユビキチンリガーゼ(ubiquitin ligase)として作用し、ユビキチンをp53に付加してプロテアソーム(proteasome)による破壊の対象となるようにする。
がんとのつながり
通常は充分な量のMDM2がp53を監視し続けている。しかし、損傷や感染が検知されるとMDM2は不活性化され、p53は問題に対処するための手段を発動できるようになる。ほとんどのがん細胞はこの過程を回避する方法を発達させている。p53自体が壊れ細胞は自身を守る手段を失ってしまう場合もある。また、がん細胞がより多くのMDM2を作り出す方法を見出している場合もある。この場合、MDM2をコードする遺伝子を複数持っていることが多い。この余分なMDM2はp53の作用を阻害し続け、がん細胞はチェックされないまま成長できてしまうことになる。
MDM2ドメイン
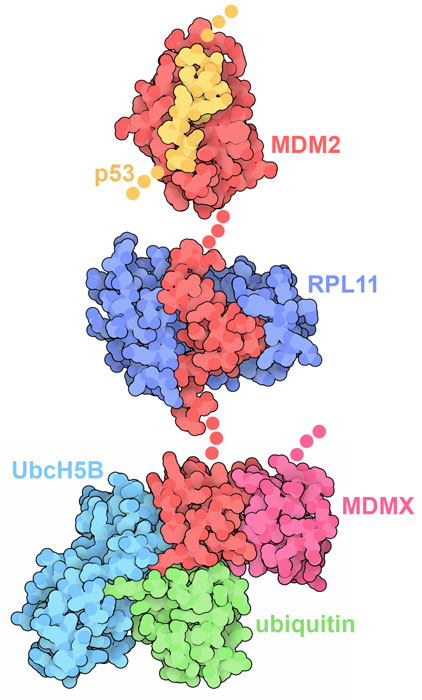
MDM2にはいくつかのつながったドメインがあり、それぞれが特定の機能を持っている。このタンパク質は非常に柔軟なので、これらのドメインは別々に構造研究が行われた。一方の端にあるN末端ドメイン(N-terminal domain)は特にp53のトランス活性化ドメインと結合してその作用を阻害する(PDBエントリー1ycr)。中央にはジンクフィンガードメイン(Zn-finger domain)があってリボソームタンパク質(ribosomal protein)と結合する(PDBエントリー4xxb)。C末端にあるRINGドメインはユビキチンをp53につなげる反応を行う(PDBエントリー5mnj)
構造をみる
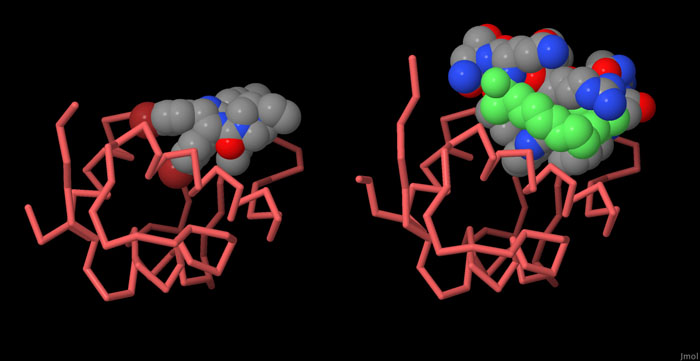
対話的操作のできるページに切り替えるには図の下のボタンをクリックしてください。読み込みが始まらない時は図をクリックしてみてください。
MDM2とp53の相互作用はがんの化学治療において効果の期待できそうな作用対象となる。なぜならこの相互作用を壊す薬はp53を活性化しがん細胞を殺すことができることが見込めるからである。MDM2のp53認識部位に結合する効果的な阻害剤としてニュートリン(nutlin、PDBエントリー1rv1)やSAH-p53-8(PDBエントリー3v3b、p53由来の小さなペプチドで、緑で示すリンカーを介ししかるべき配置場所に固定される)を含むいくつかの物質が見つかっている。図の下のボタンをクリックして対話的操作のできる画像に切り替え、これらの阻害剤とMDM2との複合体をより詳しく見てみて欲しい。
理解を深めるためのトピックス
参考文献
- 5mnj 2017 Structural analysis of MDM2 RING separates degradation from regulation of p53 transcription activity. Nat. Struct. Mol. Biol. 24 578-587
- 2016 The p53 pathway: origins, inactivation in cancer, and emerging therapeutic approaches. Annu. Rev. Biochem. 85 375-404
- 4xxb 2015 Structure of human MDM2 complexed with RPL11 reveals the molecular basis of p53 activation. Genes Dev. 29 1524-1534
- 3v3b 2012 Structure of the stapled p53 peptide bound to Mdm2. J.Am.Chem.Soc. 134 103-106
- 1rv1 2004 In vivo activation of the p53 pathway by small-molecule antagonists of MDM2. Science 303 844-848
- 2003 MDM2, an introduction. Mol. Cancer Res. 1 993-1000
- 1ycr 1996 Structure of the MDM2 oncoprotein bound to the p53 tumor suppressor transactivation domain. Science 274 948-953
 の生体高分子学習ポータルサイト
の生体高分子学習ポータルサイト 









